闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻鐔兼⒒鐎靛壊妲紒鐐劤缂嶅﹪寮婚悢鍏尖拻閻庨潧澹婂Σ顔剧磼閻愵剙鍔ょ紓宥咃躬瀵鎮㈤崗灏栨嫽闁诲酣娼ф竟濠偽i鍓х<闁绘劦鍓欓崝銈囩磽瀹ュ拑韬€殿喖顭烽幃銏ゅ礂鐏忔牗瀚介梺璇查叄濞佳勭珶婵犲伣锝夘敊閸撗咃紲闂佺粯鍔﹂崜娆撳礉閵堝洨纾界€广儱鎷戦煬顒傗偓娈垮枛椤兘骞冮姀銈呯閻忓繑鐗楃€氫粙姊虹拠鏌ュ弰婵炰匠鍕彾濠电姴浼i敐澶樻晩闁告挆鍜冪床闂備胶绮崝锕傚礈濞嗘挸绀夐柕鍫濇缁♀偓闂侀€炲苯澧撮柡灞芥椤撳ジ宕ㄩ姘曞┑锛勫亼閸婃牜鏁幒妤€纾圭憸鐗堝笒閸氬綊鏌嶈閸撶喖寮婚敐鍡樺劅闁靛繒濮村В鍫ユ⒑閸涘﹦鎳冮柛鐕佸亰閹儳鐣¢幍顔芥闂佹悶鍎滅仦缁㈡%闂備浇顕ч崙鐣屽緤婵犳艾绀夐悗锝庘偓顖嗗吘鏃堝川椤旇瀚奸梻渚€娼荤€靛矂宕㈡總绋跨閻庯綆鍠楅悡鏇㈡煏婵炲灝鍔ょ紒澶庢閳ь剝顫夊ú姗€宕濆▎鎾崇畺婵炲棗娴氶崯鍛亜閺冨洦顥夐柣锔界矒濮婄粯绗熼埀顒€岣胯閹囧幢濡炪垺绋戣灃闁告劦浜為悾鍫曟⒑缁嬫寧婀扮紒顔兼捣婢规洘绺介崨濠勫帗閻熸粍绮撳畷婊冾潩鏉堚晝鐣堕梺缁樻⒒閸樠囨倿閸偁浜滈柟鍝勬娴滈箖姊烘导娆戝埌闁搞垺鐓¢妶顏呭閺夋垿鍞跺銈嗗姧缁叉儳鈻嶅澶嬧拻濞达綀娅g敮娑㈡煕閵娾晜娑ч摶鐐寸箾閸℃ê鐏嶉柛瀣崌濡啫鈽夊鍗炲П婵犳鍠栭敃銉ヮ渻閽樺)娑㈠礃閵娿垺顫嶅┑顔斤供閸擄箓寮抽锝囩瘈缁剧増蓱椤﹪鏌涚€n亝鍤囬柕鍡楀暣瀹曞崬鈽夊Ο鑲╂澖闂備線娼чオ鎾偂閸惊锝夊礈瑜忕壕钘壝归敐鍕煓闁告繃妞介幃浠嬵敍閵堝洨鐦堝Δ鐘靛仜閸熸挳宕洪敓鐘插窛妞ゆ挾濯Σ浼存⒒娴h棄浜归柍宄扮墦瀹曟鈽夊顓ф綗濠电娀娼ч鍡涘煕閹烘嚚褰掓晲閸噥浠╅柣銏╁灡缁嬫垿濡撮幒鎴僵妞ゆ挆鍕澒闁诲氦顫夊ú妯荤箾婵犲洤鏋侀柟鐗堟緲楠炪垺淇婇姘儓濞寸厧閰e缁樼瑹閳ь剟鍩€椤掑倸浠滈柤娲诲灡閺呭爼骞橀鐣屽幐闁诲繒鍋熼崑鎾剁矆鐎n兘鍋撶憴鍕闁告鍥х厴闁硅揪绠戦悙濠囨煠閸濄儺鏆滃Δ鐘茬箻濮婂宕掑▎鎴М闂佸湱瀵介妶鍡樺櫡闂傚倷绀佸﹢閬嶅箠閹捐秮娲敇閻戝棗娈ㄦ繝鐢靛У閼归箖鎮炲ú顏呯厱闁规壋鏅涙俊璺ㄧ磼閹邦喖浠遍柡宀嬬秬缁犳盯寮撮悙鐗堝媰闂備焦鎮堕崝宥囨崲閸岀偛鐓濆ù鐘差儛閺佸倿鏌涘☉鍗炵仯闁伙箑鐗撳娲濞戞氨鐤勯梺鎼炲妽濡炶棄鐣烽悽绋跨劦妞ゆ巻鍋撻柍瑙勫灴閸┿儵宕卞鍓у嚬缂傚倷娴囬褔宕愰崸妤€绠栭柟顖嗗懏娈濋梺閫涚祷濞呮洟寮埀顒勬⒒娴h櫣銆婃俊鐙欏洤鐤炬繛鎴欏灩缁犳牠鏌熸潏楣冩闁抽攱鍨圭槐鎺楊敍濞戞瑧顦ユ繝鈷€鍕弨闁哄本鐩顕€鍩€椤掑倹鏆滈柣鎰劋閸ゅ秹寮堕崼娑樺缂佲檧鍋撴繝娈垮枟閿曗晠宕㈤幖浣哥婵炲樊浜濋埛鎴︽煕濞戞﹫鍔熺紒鐘虫崌閹顫濋悡搴♀拫闂佺硶鏂侀崑鎾愁渻閵堝棗绗傞柣鎺炵畵瀹曟劙骞囬悧鍫㈠幍濡炪倖姊婚悡顐︻敂閸繄鍘撮梺鐟邦嚟婵參宕戦幘缁樻櫜闁告侗鍨划鐢告⒑閸濆嫭鍣虹紒顔肩焸閳ユ棃宕橀鍢壯囨煕閳╁喚娈旀い顐㈡喘濮婅櫣绮欓崠鈩冩暰濡炪們鍔岄悧濠勭博閻旂厧鍗抽柣鏃€妞藉顔剧磽娴e壊鍎撴繛澶嬫礃椤ㄣ儵宕堕浣叉嫼闂佸憡鎸昏ぐ鍐╃濠靛牏纾奸悗锝庡亜閻忥箑菐閸パ嶈含闁诡喖澧芥禒锔剧矙婢剁ǹ顥氶梺鑽ゅ枑閻熴儳鈧凹鍘剧划鍫ュ焵椤掑嫭鈷戞繛鑼额嚙婢ь噣鏌曢崼鐔稿€愮€规洘妞介崺鈧い鎺嶉檷娴滄粓鏌熼悜妯虹仴闁哄鍊栫换娑㈠礂閻撳骸顫嶇紓浣虹帛閻╊垰鐣烽敐鍡楃窞闁告侗鍨崇粣妤呮⒒娴h姤銆冪紒璁圭節瀹曟娊鏁愭径灞界ウ闂佸湱鍎ら崵锕傚籍閸屾浜鹃柨婵嗛婢т即鏌嶇粭鍝勨偓鏍崲濠靛鍋ㄩ梻鍫熺▓閺嬪懎鈹戦悙鏉垮皟闁搞儴鍩栭弲鐐烘⒑閸︻厼顣兼繝銏★耿瀵憡绗熼埀顒勫蓟濞戙垹鍗抽柕濞垮劤娴狀參姊虹紒妯诲蔼闁搞劎鍎ょ粚杈ㄧ節閸ヨ埖鏅┑鐐叉鐢晠宕濋崨顓涙斀闁斥晛鍟徊濠氭煕閵忥紕鍙€闁炽儻濡囬幑鍕Ω閿曗偓閺嬪倿姊洪崨濠冨闁告挻鐩棟闁哄绨遍弨鑺ャ亜閺冨倶鈧寮ㄧ紒妯圭箚闁绘劘鍩栭ˉ澶愭煟閿濆洤鍘村┑鈩冩倐閺佸倿宕滆濡插洭姊绘担鍛婂暈婵炶绠撳畷銏ゅ礈瑜忛悳缁樹繆閵堝懏鍣洪柍閿嬪笒闇夐柨婵嗘噺閸ゅ牓鏌涢敂璇插箰闁稿鎸搁埥澶愬箳閹惧褰嗙紓鍌欒兌缁垳绮欓幒鏃€宕叉繝闈涱儏閻愬﹦鎲歌箛娑欏仼濡わ絽鍟悡鐔肩叓閸ャ劍绀€濞寸姭鏅濋幃顔尖枎閹惧鍘搁柣搴秵娴滎亪宕i崟顖涚厸鐎光偓閳ь剟宕伴弽顓犲祦闁糕剝鍑瑰銊╂⒑閹肩偛鈧宕伴弽顓炶摕婵炴垶锕╁ḿ銊╂煃瑜滈崜姘辩矉瀹ュ洦宕夊〒姘煎灡缂嶅骸鈹戦悙鍙夆枙濞存粍绮嶇€靛ジ鎮╃紒妯煎幈闂佸搫娲㈤崝灞炬櫠椤曗偓閺屾稓鈧綆浜炴晥濠殿喖锕ュ钘夌暦閵婏妇绡€闁告劦浜滃鎶芥⒒娴h銇熼柛妯恒偢瀹曟劙宕稿Δ鍐ㄧウ闂佸憡鍔﹂悡鍫濁缚閵娾晜鐓冪憸婊堝礈閻旇偐宓侀柛鎰靛枛閻撴盯鏌涘☉鍗炴灈濞寸姵妞藉鍝勑ч崶褏浼勫銈忕秵閸犳艾危閹版澘钃熼柕澶涜吂閹风粯绻涙潏鍓хК婵炲拑绲块弫顔尖槈閵忥紕鍘介梺缁樻⒐濞兼瑩鎮橀懠顑藉亾鐟欏嫭绀冮柛銊ユ健閻涱喖螣閼测晝锛滃┑鈽嗗灣閸樠囩嵁閸儲鈷掑〒姘e亾婵炰匠鍕粴闂備胶枪鐎涒晜绻涙繝鍌滄殾婵炲樊浜濋弲鏌ユ煕閵夘垳鍒板ù婊呭亾缁绘盯宕煎┑鍫滆檸闂佸搫顑嗙粙鎺楀Φ閸曨垼鏁囬柕蹇婂墲閺嗙姵绻涢敐鍛悙闁挎洦浜悰顕€寮介妸锕€顎撻梺鍛婄缚閸庨亶鐛幇鐗堚拻濞达絽鎳欒ぐ鎺戝珘妞ゆ帒瀚崕妤併亜閺冣偓瀹曟ɑ鎱ㄩ崘瑁佸綊鎮╁顔煎壉闂佹娊鏀辩敮鎺楁箒闂佹寧绻傞幊蹇涘吹閸垺鍠愰柣妤€鐗嗙粭鎺楁倵濮橆剦妲归柕鍥у楠炴帡骞嬪┑鍐ㄤ壕濠电姵纰嶉崕妤佺箾閸℃ɑ灏伴柣鎾寸懇瀵爼宕奸悢宄板Б闂佷紮闄勭划鎾诲蓟閳╁啯濯寸紒瀣氨閸嬫捇宕稿Δ鈧拑鐔兼煏婵炵偓娅嗛柛瀣閺屾稓浠﹂崜褉妲堝銈呴獜閹凤拷婵犵數濮烽弫鍛婃叏閻戣棄鏋侀柛娑橈攻閸欏繘鏌i幋锝嗩棄闁哄绶氶弻娑樷槈濮楀牊鏁鹃梺鍛婄懃缁绘﹢寮婚敐澶婄闁挎繂妫Λ鍕⒑閸濆嫷鍎庣紒鑸靛哺瀵鈽夊Ο閿嬵潔濠殿喗顨呴悧濠囧极妤e啯鈷戦柛娑橈功閹冲啰绱掔紒姗堣€跨€殿喖顭烽弫鎰緞婵犲嫷鍚呴梻浣瑰缁诲倸螞椤撶倣娑㈠礋椤栨稈鎷洪梺鍛婄箓鐎氱兘宕曟惔锝囩<闁兼悂娼ч崫铏光偓娈垮枦椤曆囧煡婢跺á鐔兼煥鐎e灚缍屽┑鐘愁問閸犳銆冮崨瀛樺亱濠电姴娲ら弸浣肝旈敐鍛殲闁抽攱鍨块弻娑樷槈濮楀牆濮涢梺鐟板暱閸熸壆妲愰幒鏃傜<婵鐗愰埀顒冩硶閳ь剚顔栭崰鏍€﹂悜钘夋瀬闁归偊鍘肩欢鐐测攽閻樻彃顏撮柛姘嚇濮婄粯鎷呴悷閭﹀殝缂備浇顕ч崐姝岀亱濡炪倖鎸鹃崐锝呪槈閵忕姷顦板銈嗙墬缁嬪牓骞忓ú顏呪拺闁告稑锕︾粻鎾绘倵濮樺崬鍘寸€规洘娲橀幆鏃堟晲閸モ晪绱查梻浣稿悑閹倸岣胯瀹曨偊鎼归崗澶婁壕婵炲牆鐏濋弸娑欍亜椤撶姴鍘存鐐插暣婵偓闁靛牆鎳愰ˇ褔鏌h箛鎾剁闁绘顨堥埀顒佺煯缁瑥顫忛搹瑙勫珰闁哄被鍎卞鏉库攽閻愭澘灏冮柛鏇ㄥ幘瑜扮偓绻濋悽闈浶㈠ù纭风秮閺佹劖寰勫Ο缁樻珦闂備礁鎲¢幐鍡涘椽閸愵亜绨ラ梻鍌氬€峰ù鍥敋閺嶎厼鍨傞幖娣妼缁€鍐煥濠靛棙顥滈柣锕佷含缁辨捇宕掑顑藉亾妞嬪孩顐介柨鐔哄Т闂傤垱銇勯弴妤€浜鹃悗瑙勬礀缂嶅﹪鐛惔銊﹀癄濠㈣泛鐭堥崬褰掓⒒娓氣偓濞佳呮崲閹烘挻鍙忔い鎾跺€i敐澶婇唶闁靛濡囬崢顏堟椤愩垺澶勬繛鍙夌墪閺嗏晜淇婇悙顏勨偓鏍箰鐠囧樊娓婚柦妯侯樈濞兼牗绻涘顔荤盎濞磋偐濞€閺屾盯寮撮妸銉ょ凹濠电偛鐗婄划鎾愁潖閾忓湱鐭欐繛鍡樺劤閸撻亶姊洪崷顓熷殌婵炲樊鍘奸锝囨嫚濞村顫嶉梺闈涚箳婵牐顦归柡灞剧☉閳藉宕¢悙纰樺亾閾忚鍠愰柡鍐ㄧ墕閽冪喖鏌ㄥ☉妯侯仹婵炲矈浜弻娑㈠箻濡も偓鐎氼剟宕归崡鐐╂斀闁绘ɑ顔栭弳婊呯磼鏉堛劍绀嬬€规洘顨呴~婊堝焵椤掑嫬违濞达絿纭堕弸搴ㄦ煙閻愵剚缍戝ù婊勵殜閺岀喖鎮℃惔锝嗘喖闁藉啴浜堕幃妤€顫濋銈囩厯濠殿喖锕ら…宄扮暦閹烘垟鏋庨柟閭﹀枔閸嬫ɑ绻濈喊妯哄⒉闁靛洦绮撳畷婵囨償閿濆懎鐏婇梺鍓插亞閸犳劖鍒婇幘顔藉仯闁搞儯鍎遍崝婊勪繆閻愭壆鐭欓柕鍡曠椤粓鍩€椤掍焦鍙忛柍褜鍓熼弻锝呂熼悡搴″闂佺寮撻崡鍐差潖缂佹ɑ濯撮柛娑橈攻閸庢挸鈹戦悙瀛樼稇閻庢凹鍠栧嵄闁圭増婢橀崡鎶芥煏韫囧ň鍋撻崗鍛/闂傚倷绶氶埀顒傚仜閼活垱鏅剁€涙ɑ鍙忓┑鐘插暞閵囨繄鈧娲﹂崑濠傜暦閻旂⒈鏁嗛柍褜鍓涚划锝呪槈閵忊檧鎷虹紓浣割儏缁ㄩ亶鎯囩€n喗鐓曢悗锝庝悍閺€璇睬庨崶褝韬柟顔界矒閹崇偤濡烽敂鐣屽絾闂備礁鎼ˇ閬嶅磻閻愬鐝堕柛鈩冪⊕閸庡酣骞栧ǎ顒€濡介柍閿嬪笒闇夐柨婵嗘处閸も偓濡炪倖娲樼划宥嗙┍婵犲浂鏁冮柨娑樺閻涖垹顪冮妶鍐ㄧ仾濞e洦妞借棟闁哄被鍎查悡鍐偣閸ヮ亜鐨虹€涙繂顪冮妶鍡樺碍闁告艾顑呴銉╁礋椤撴稑浜鹃柨婵嗛婢ь喗顨ラ悙鑼eǎ鍥э躬閹瑩顢旈崟銊ヤ壕闁哄诞灞剧稁婵犵數濮电喊宥夊磻閵堝鐓涢柛灞炬皑濮樸劑鏌$€n偅鈷愮紒缁樼箖缁绘繈宕掑☉妯荤彺闂備胶枪椤戝棝骞愭ィ鍐ㄧ疅闁圭虎鍠栫粈瀣亜閹烘垵浜炴俊鑼娣囧﹪鎮欓鍕ㄥ亾閹达箑绀夐悘鐐跺▏濞戞鏃堝椽娴h娅旈梻渚€娼чˇ顐﹀疾濞戞氨鐭嗛悗锝庡亖娴滄粓鏌熼悜妯虹仴闁逞屽墮椤兘骞嗘笟鈧畷濂告偄閾忚鍟庨梺鍝勵槸閻楀棙鏅舵禒瀣闁哄顑欓悢鍡涙煟閻斿嘲绨荤€规悶鍎甸幗鍫曟倷鐎靛摜鐦堟繝鐢靛Т閸婄粯鏅跺☉銏$厓闂佸灝顑呭ù顕€鏌$仦鍓с€掑ù鐙呯畵楠炴垿骞囬澶嬵棨闂傚倷绶氶埀顒傚仜閼活垱鏅剁€涙ǜ浜滈柕澶涢檮鐏忕敻鏌涢幒鎾虫诞鐎规洖銈搁幃銏ゆ惞鐟欏嫬娈為梻鍌欑窔閳ь剛鍋涢懟顖涙櫠閹绢喗鐓熸繛鎴濆船閺嬬喓鈧灚婢樼€氫即鐛崶顒夋晢闁稿本鐟х粈鍫ユ⒒娴e搫鍔﹂柛鎾寸箘閺侇喗绻濋崶銊モ偓鍧楁煥閺囨浜惧銈庝簻閸燁垳绮嬮幒鏂哄亾閿濆簼绨奸柣搴墴濮婃椽宕ㄦ繝鍌毿曢梺鍝ュУ閻楁粍绔熼弴銏犵闁稿繒鍘у鍨攽閳藉棗鐏ユい鏇嗗洤鏋侀柛鎾楀懐锛滈梺鍛婎殘閸嬫盯鎳滆ぐ鎺撶厓閻熸瑥瀚悘鎾煙椤旇娅婃い銏$懇閹虫牠鍩¢埀顒傛濮椻偓濮婄粯鎷呴搹骞库偓濠囨煛閸涱喚鐭掗柟顔ㄥ洦鍋愰柤纰卞墯濞堟儳鈹戦悩缁樻锭妞ゆ垵鎳樺畷锟犲箮閼恒儳鍘棅顐㈡处濞叉牕鐡柣搴㈩問閸犳岸宕楀Ο渚綎婵炲樊浜濋ˉ鍫熺箾閹达綁鍝虹€涙繈姊绘担鍛婃儓闁瑰啿绻掗崚鎺楀箻鐠囪尙鐣洪梺璺ㄥ枔婵敻宕戦崟顖涚厱闊洦鑹炬禍褰掓煕濡吋鏆慨濠勭帛缁楃喖宕惰娴煎海绱撴担鍝勑i柛銊ョ仢椤曪絿绮欐惔鎾搭潔闂侀潧楠忕槐鏇㈠储闁秵鈷戦柛婵嗗閳ь剙缍婇、鏍р枎閹惧磭锛熼梺鍝勫暙閻楀﹪鎮″☉銏″€堕柣鎰仛濞呮洟寮崼銉︹拺闁告繂瀚~锕傛煕閺傚潡鍙勯柛鈹惧亾濡炪倖甯掗敃锔剧矓闂堟耽鐟扳堪閸涱厺娌柣搴f暩閸樠囨偩濠靛绀嬫い鎴eГ鐎氬ジ姊洪懡銈呅㈡繛鑼█閸┾偓妞ゆ帒鍟悵顏堟煟韫囨挾澧㈢紒杈ㄦ崌瀹曟帒顫濆В娆嶅灲閺屻劑寮撮妸銈夊仐闂佽鍠曢崡鎶姐€佸▎鎾村仼鐎光偓閳ь剟骞婂┑瀣拺闂侇偆鍋涢懟顖涙櫠閹绢喗鐓熸繛鎴濆船濞呭秵顨ラ悙鏉戠瑨閾绘牠鏌嶈閸撴稓鍒掓繝姘櫜闁糕剝鐟ч惁鍫ユ⒑閸撹尙鍘涢柛瀣閹便劍寰勯幇顓犲帗閻熸粍绮撳畷婊冣攽閸″繑鐎洪梺鍝勬川婵潧鐣烽崣澶岀瘈闂傚牊渚楅崕鎰版煕鐎c劌濮傛慨濠傤煼瀹曞ジ鎮㈢悰鈩冿級缂傚倷绶¢崰鏍偉閻撳寒娼栨繛宸簼閸嬶繝鏌℃径瀣嚋婵絾鍔楃槐鎾存媴閾忕懓绗¢梺鎸庡哺閺岋綁鏁愰崨顓熜╅梺瀹狀潐閸ㄥ灝鐣锋潏顐ょ杸闁哄啫鍊甸崑鎾寸節濮橆厸鎷洪柣鐔哥懃鐎氼剟宕濋妶澶嬬厽闁靛牆鎳忛崰妯活殽閻愭惌娈滅€殿喗鎸虫慨鈧柍閿亾闁圭柉娅g槐鎾诲磼濞嗘垵濡介柦鍐憾閺屽秹鏌ㄧ€n亝璇為梺鍝勬湰缁嬫垼鐏掗梺缁樏鍫曞闯娴犲鐓熸い鎾跺仦椤ャ垽鏌$仦鍓ф创鐎殿喗鎸虫俊鎼佸Ψ瑜岄悽濠氭⒒娴h櫣甯涢柟绋挎憸閹广垹顫滈埀顒€顕g拠娴嬫闁靛繆鏅滈弲婵嬫⒑閹稿海绠撴繛灞傚姂閹箖宕崟鍨瘜闂侀潧鐗嗛崯顐﹀礉濠婂懐纾兼い鏃囧亹鏁堟繝纰夌磿閺佽鐣烽悢纰辨晩闁告挆鍕帆闂傚倷绶氬ḿ褔篓閳ь剛绱掗悩鍐茬伌妞ゃ垺妫冮弫鎾绘晸閿燂拷
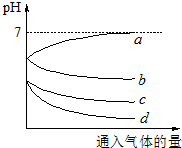 向等体积等物质的量浓度的H2S和SO2的水溶液各两份中,分别通入不同的气体,一段时间后,如图表示通入的气体的量与溶液pH关系的曲线图,下列说法中正确的是
向等体积等物质的量浓度的H2S和SO2的水溶液各两份中,分别通入不同的气体,一段时间后,如图表示通入的气体的量与溶液pH关系的曲线图,下列说法中正确的是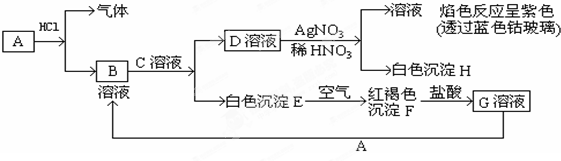
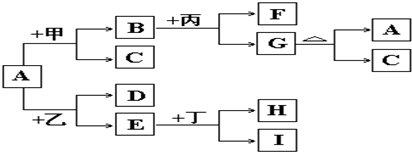

 SiCl4+2CO
SiCl4+2CO 海带灰
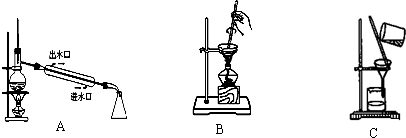
海带灰 浸泡液
浸泡液 I2(CCL4)→I2
I2(CCL4)→I2