
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定.
某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目: 来源: 题型:多选题
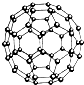 N60结构如图,28g N60单质中含有的N-N键个数为NA
N60结构如图,28g N60单质中含有的N-N键个数为NA查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
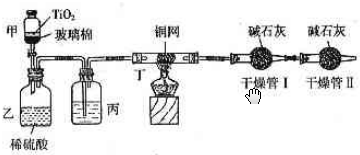
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com