
科目: 来源: 题型:单选题
 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如右图所示).下列说法错误的是
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如右图所示).下列说法错误的是查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
 图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是
图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是 查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
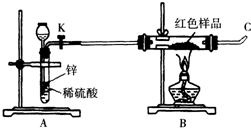 已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,而Cu2O在空气中灼烧可以生成CuO.
已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,而Cu2O在空气中灼烧可以生成CuO.| 方案甲 | 取该红色沉淀溶于稀硫酸中,观察是否有残渣. |
| 方案乙 | 取该红色沉淀溶于稀硝酸中,观察溶液颜色. |
| 方案丙 | 称取红色沉淀a g,在空气中充分灼烧至完全变成b g黑色的CuO,比较a和b的关系. |
查看答案和解析>>
科目: 来源: 题型:单选题
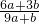
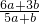
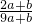
查看答案和解析>>
科目: 来源: 题型:单选题
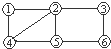 如图所示,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应.供选择的物质有:a.铁;b.稀H2SO4;c.Na2CO3溶液;d.BaCl2溶液;e.Cu(NO3)2溶液;f.MgSO4溶液.图中编号④代表的物质是
如图所示,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应.供选择的物质有:a.铁;b.稀H2SO4;c.Na2CO3溶液;d.BaCl2溶液;e.Cu(NO3)2溶液;f.MgSO4溶液.图中编号④代表的物质是查看答案和解析>>
科目: 来源: 题型:解答题
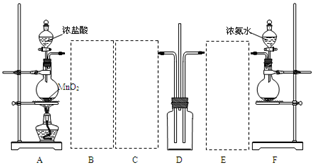
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com