
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题

 得到碘酸钾晶体,你建议的方法是______.
得到碘酸钾晶体,你建议的方法是______.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
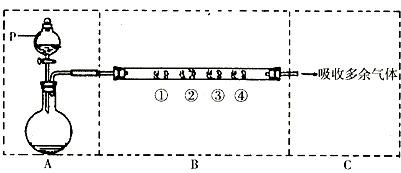
查看答案和解析>>
科目: 来源: 题型:单选题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 已知部分常见物质转化时,可以存在如图所示的三角转化关系.已知图中每个小三角形内的三种物质至少含有第三周期中的一种相同元素,且图示中所有物质均由短周期元素组成.D为能助燃的气体单质;E为酸性氧化物,能与酸反应,F不溶于水.H为淡黄色固体化合物,电解饱和J溶液是工业上的重要反应.C为离子化合物,阴、阳离子均含有金属元素.
已知部分常见物质转化时,可以存在如图所示的三角转化关系.已知图中每个小三角形内的三种物质至少含有第三周期中的一种相同元素,且图示中所有物质均由短周期元素组成.D为能助燃的气体单质;E为酸性氧化物,能与酸反应,F不溶于水.H为淡黄色固体化合物,电解饱和J溶液是工业上的重要反应.C为离子化合物,阴、阳离子均含有金属元素.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com