
科目: 来源: 题型:
(8分)甲、乙两个研究小组,用以下两种方法由Cu粉制Cu(NO3)2溶液。
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗的O2的物质的量是 ,消耗的HNO3的物质的量是 。
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L(不考虑NO2转化成N2O4)。则消耗的HNO3物质的量是 mol。为消除污染,将生成的气体通入NaOH溶液中,气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是 mol。若欲使生成的气体在NaOH溶液中全部转化为NaNO3,至少需要34%的双氧水 g.
查看答案和解析>>
科目: 来源: 题型:
(6分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
![]()
(1)若反应达平衡前某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值:a= 。
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量:n(NH3)= 。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简单整数比,下同):n(始):n(平)= 。
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比:α (N2):α (H2)= ;
(6)平衡混合气体中,n(N2):n(H2):n(NH3)= 。查看答案和解析>>
科目: 来源: 题型:
(8分)某校课外小组为了探究铜与稀硝酸反应产生的是NO而设计了一个实验。其装置如图(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器,D是尾气处理装置。请回答有关问题:
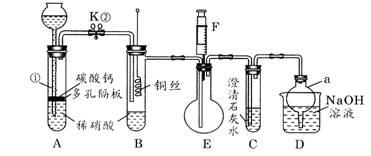 |
(1)如何检查装置A的气密性 。
(2) 设计装置A的目的是 ;为达此目的,应如何操作
。
(3)在(1)中的“操作”后将装置B中铜丝插入稀硝酸并微热,观察到装置B中的现象是 ;B中反应的离子方程式是 。
(4)装置E和F的作用是 ;为验证实验此作用,其操作方法和现象是 。
(5)D部分仪器a的作用是 。
查看答案和解析>>
科目: 来源: 题型:
(8分)X、Y、Z是短周期元素的单质,A、B是它们的化合物。物质之间的转化关系如图所示(其中反应条件和某些生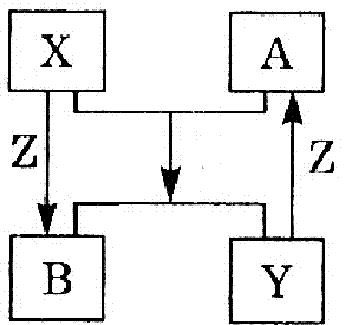
成物已略去):
(1)如果X、Y组成元素是同主族时,按下列要求分别写出“A+X=B+Y”的化学方程式:
①若B为水,则化学方程式为: ;
②已知A、B都是氧化物,则化学方程式为: 。
(2)如果X、Y的组成元素不是同一主族时,按下列要求写出X+Z=B的化学方程式:
①若X的组成元素是地壳中含量最多的金属元素,则化学方程式为 。
②若Y的组成元素是地壳中含量最多的非金属元素,则化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
(8分)现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A、E同主族,A元素原子半径最小。B元素原子的最外层电子数是内层电子数的2倍。C元素最高价氧化物的水化物X能与其氢化物Y反应生成盐。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。
(1)写出X与Y反应生成盐的化学方程式 。
(2)A、B、D、E四种元素组成的某无机盐受热易分解。写出少量该化合物与足量的Ba(OH)2溶液反应的离子方程式 。
(3)C与D形成的具有相同价态化合物之间发生相互转化的化学方程式 。
(4)B、C、D与A可形成电子总数相同的化合物,写出其中非极性分子的结构式和键角 , 。
(5)C可与A形成多种化合物CA3、C2A4、CA5等,写出CA3→CD的化学方程式 ,已知C2A4,CA5中各原子数外层均达到稳定结构,试写出两者的电子式 , 。
查看答案和解析>>
科目: 来源: 题型:
(6分)A、B、C、D、E均为可溶于水的固体化合物,组成它们的离子有:Na+、Mg2+、Ba2+、ClO-、HSO4-、CO32-、Cl-。分别取它们的溶液进行实验,主要操作及现象如下:
①向A的溶液中通入二氧化碳,再加入品红溶液,红色褪去;
②A、B、E的溶液的焰色反应都呈黄色;
③将B和C的溶液混合,生成白色沉淀,该沉淀可溶于E溶液;
④将B和D的溶液混合,生成白色沉淀,继续加入过量的E溶液,有气泡产生的同时还有白色沉淀存在。
(1)写出下列物质的化学式:A ,C 。
(2)向B的溶液中,缓慢滴入少量的E溶液,其主要的离子方程式为:
。
查看答案和解析>>
科目: 来源: 题型:
(1)某反应体系中有反应物和生成物共五种物质:P、H3PO4、H2O、HNO3、NO2。已知该反应中发生的还原过程为:HNO3 →NO2
①完成上述反应的化学方程式: 。
②若反应转移0.5mol电子,则产生的气体在标况下的体积约为: 。
(2)氮化硅是一种高温陶瓷材料,其硬度大、熔点高、化学性质稳定。
①已知氮化硅中各原子最外层均达到8电子稳定结构,请写出氮化硅的化学式 。
②现用四氯化硅和氮气在氢气气氛保持下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
(2分)下列实验操作或对实验事实的叙述正确的是 (填序号)
①用BaCl2检验Na2SO3固体是否变质;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③用托盘天平称取10.50g干燥的NaCl固体;
④用瓷坩埚高温熔融Na2CO3固体;
⑤用200mL量筒量取5.2mL稀硫酸;
⑥用100mL容量瓶配制95mL物质的量浓度为1mol/L的食盐水;
⑦用浓硫酸干燥二氧化硫气体。
⑧用淀粉KI试纸鉴别Br2与NO2气体;
⑨用水鉴别CuSO4、NaCl、NaOH、NH4NO3固体。
查看答案和解析>>
科目: 来源: 题型:
向1L 0.4mol?L-1H2SO4溶液中加入10.1g KNO3和9.6g铜粉,充分反应后产生的气体在标准状况下的体积为
A、2.24L B、3.36L C、4.48L D、5.60L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com