
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
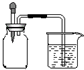 如图所示,集气瓶内充满某混合气体,将滴管内的水挤入集气瓶后,烧杯中的水会进入并充满集气瓶,集气瓶内气体可能是
如图所示,集气瓶内充满某混合气体,将滴管内的水挤入集气瓶后,烧杯中的水会进入并充满集气瓶,集气瓶内气体可能是查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
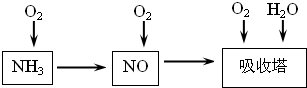
 2NH3,该反应在固定容积的密闭容器中进行.下列各项标志着该反应达到化学平衡状态的是______(填序号)
2NH3,该反应在固定容积的密闭容器中进行.下列各项标志着该反应达到化学平衡状态的是______(填序号)查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
| 转化率% 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目: 来源: 题型:填空题
 2FeCl3,其中氯元素的化合价________(填“升高”或“降低”),被________(填“氧化”或“还原”,下同);Cl2作________剂,具有________性.在该反应中,若消耗了1mol Fe,则生成________mol FeCl3.
2FeCl3,其中氯元素的化合价________(填“升高”或“降低”),被________(填“氧化”或“还原”,下同);Cl2作________剂,具有________性.在该反应中,若消耗了1mol Fe,则生成________mol FeCl3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com