
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
 所示转化的是
所示转化的是| 物质选项 | a | b | c | m |
| A | N2 | NO | HNO3 | O2 |
| B | Cl2 | FeCl3 | FeCl2 | Fe |
| C | Na2CO3 | NaHCO3 | NaOH | CO2 |
| D | CH3CH2OH | CH3CHO | CH3COOH | O2 |
查看答案和解析>>
科目: 来源: 题型:单选题
| 选项 | A | B | C | D |
| 实验目的 | 除去KCl中少量MnO2 | 用10mol?L-1盐酸配制 100mL 0.1mol?L-1盐酸 | 用NaCl溶液制备氯化钠晶体 | 除去C2H4中少量SO2 |
| 实验仪器 或装置 | 烧杯、玻璃棒、分液漏斗 | 100mL容量瓶、玻璃棒、烧杯 | 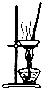 | 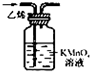 |
查看答案和解析>>
科目: 来源: 题型:解答题
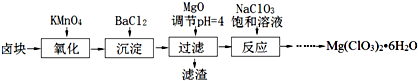
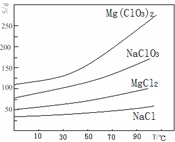
查看答案和解析>>
科目: 来源: 题型:解答题
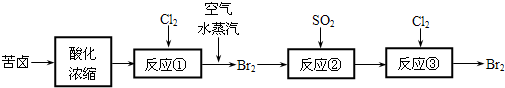
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com