
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

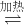 2Fe(s)+3CO(g)△H=-492.7kJ?mol-1
2Fe(s)+3CO(g)△H=-492.7kJ?mol-1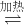 2Fe(s)+3CO2(g)△H=+25.2kJ?mol-1
2Fe(s)+3CO2(g)△H=+25.2kJ?mol-1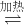 4Fe(s)+3CO2(g)△H=______kJ?mol-1
4Fe(s)+3CO2(g)△H=______kJ?mol-1查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
下列各组关于强电解质、弱电解质、非电解质的归类正确的
| A | B | C | D | |
| 强电解质 | C | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | HCl | H2O |
| 非电解质 | 蔗糖 | BaSO4 | C2H5OH | 酒精 |
查看答案和解析>>
科目: 来源: 题型:解答题
 制取氨气并完成喷泉实验:
制取氨气并完成喷泉实验:查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全; ⑥过滤、洗涤、干燥沉淀、称量得到bg固体. | ④将25.00mL溶液置于锥形瓶中; ⑤用0.1mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液. |
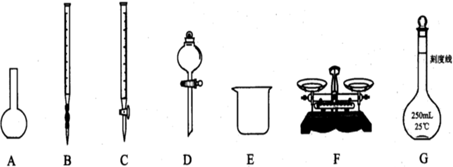
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com