科目:
来源:0103 月考题
题型:填空题
甲、乙、丙、丁四种物质在一定条件下均能与水反应放出气体。
(1)若甲是由短周期元素形成的单质,并且该元素的原子最外电子层上的电子数为其内层电子层数的二分之一,则甲元素的原子结构示意图为____________,甲与水反应的离子方程式为_________________;
(2)乙为甲的稳定的氧化物,写出乙在与水反应中氧化剂的电子式____________;19.5g乙与足量的水反应转移电子的物质的量为____________mol;
(3)丙为地壳中金属元素含量排位第二的元素形成的单质,写出它与水蒸气反应的化学方程式________________________;在实验室里,配制丙的高价氯化物溶液时要加入一定量的盐酸,解释原因并写出离子反应方程式:________________________;
(4)丁是由两种均为10个电子的微粒组成的化合物,它与碱反应能生成一种有刺激性气味的气体X,X分子中也含有10个电子,则丁属于____________类型的晶体,从综合效益角度出发,在工业上生产X时,既要增大单位时间内X产量,又要提高X的产率,可采取的措施是(填写下列合理选项的序数)
_______________。
①减压 ②加压 ③升温 ④降温 ⑤适宜的温度和压强 ⑥加催化剂
⑦及时从平衡体系中分离出X ⑧分离出X后的原料气循环使用并补充原料
查看答案和解析>>
科目:
来源:0103 月考题
题型:不定项选择题
有下列五个化学方程式(X、Y、Z均为正值)
①C
2H
2(g)+H
2(g)

C
2H
4(g)
②CH
4(g)

H
2(g)+1/2C
2H
4(g)
③C(s)+2H
2(g)

CH
4(g);△H=-X kJ·mol
-1 ④C(s)+1/2H
2(g)

1/2C
2H
2(g);△H=-Y kJ·mol
-1
⑤C(s)+H
2(g)

1/2C
2H
4(g);△H=-Z kJ·mol
-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③-⑤式中关于X、Y、Z的大小顺序排列正确的是
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Z>X>Y
查看答案和解析>>
科目:
来源:0103 月考题
题型:不定项选择题
将1mol H
2(g)和2mol I
2 (g)置于某2L密闭容器中,在一定温度下发生反应:H
2(g)+I
2(g)
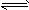
2HI(g);
ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是
A.恒温条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
查看答案和解析>>
科目:
来源:河北省期末题
题型:单选题
工业制取硫酸有一步重要反应是SO
2在400~500°C下的催化氧化,2SO
2+O
2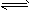
2SO
3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法中错误的是
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2不可能100%的转化为SO3
C.为了提高SO2的转化率,应适当提高O2的浓度
D.达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:
来源:0116 期末题
题型:单选题
下图表示2A(g)+B(g)
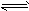
2C(g)(正反应放热)。这个可逆反应的正确图像为
查看答案和解析>>
科目:
来源:0116 期末题
题型:填空题
t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:
3A (g)+B(g)
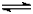
xC(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为
0.4mol/L,请填写下列空白:
(1)v(B)=___________mol/(L·min), v(C)=___________mol/(L·min),x=___________。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=________________;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是
____________(填写字母序号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率保持不变
查看答案和解析>>

 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是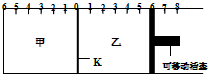
 3C(g)+D(s),反应达到平衡时C的浓度为1.2mol/L。
3C(g)+D(s),反应达到平衡时C的浓度为1.2mol/L。 2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2) 随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2) 随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是 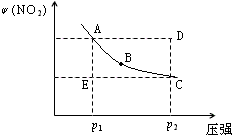
 2NH3的正反应速率加快的是
2NH3的正反应速率加快的是  C2H4(g)
C2H4(g) H2(g)+1/2C2H4(g)
H2(g)+1/2C2H4(g) CH4(g);△H=-X kJ·mol-1
CH4(g);△H=-X kJ·mol-1  1/2C2H2(g);△H=-Y kJ·mol-1
1/2C2H2(g);△H=-Y kJ·mol-1 1/2C2H4(g);△H=-Z kJ·mol-1
1/2C2H4(g);△H=-Z kJ·mol-1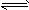 2HI(g);
2HI(g);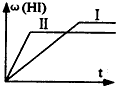
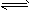 2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法中错误的是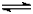 xC(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为
xC(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为