
科目: 来源:同步题 题型:不定项选择题
 N2(g)+2CO2(g) △H=-746. 6kJ/mol。下列有关叙述中不正确的是
N2(g)+2CO2(g) △H=-746. 6kJ/mol。下列有关叙述中不正确的是查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题

查看答案和解析>>
科目: 来源:期末题 题型:单选题
查看答案和解析>>
科目: 来源:期末题 题型:不定项选择题
 2N2(g)+3H2O(g) △H<0,在恒容密闭容器中,下列有关说法正确的是
2N2(g)+3H2O(g) △H<0,在恒容密闭容器中,下列有关说法正确的是 查看答案和解析>>
科目: 来源:期末题 题型:填空题
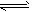 CO2(g)+H2(g)△H<0 CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=_________,该温度下平衡常数K的数值为________。
CO2(g)+H2(g)△H<0 CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=_________,该温度下平衡常数K的数值为________。 
查看答案和解析>>
科目: 来源:期末题 题型:单选题
 CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO的浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO的浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体,能提高COCl2转化率的是 [ ]
查看答案和解析>>
科目: 来源:期末题 题型:单选题
 CO2(g)+H2(g)其化学平衡常数K和温度T有如下关系,则下列有关的叙述不正确的是
CO2(g)+H2(g)其化学平衡常数K和温度T有如下关系,则下列有关的叙述不正确的是 
查看答案和解析>>
科目: 来源:期末题 题型:不定项选择题
 2NH3(g) △H=-92. 4kJ/mol)
2NH3(g) △H=-92. 4kJ/mol) 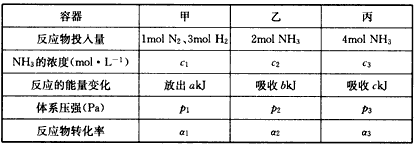
查看答案和解析>>
科目: 来源:期末题 题型:不定项选择题
 CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
CH3CH2OH(g)+3H2O(g)。下列叙述错误的是 查看答案和解析>>
科目: 来源:期末题 题型:填空题
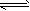 CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ/mol)的变化。
CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ/mol)的变化。 
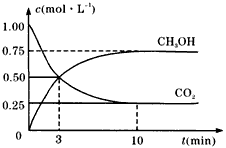
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com