
科目: 来源:浙江省模拟题 题型:填空题
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 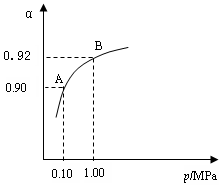
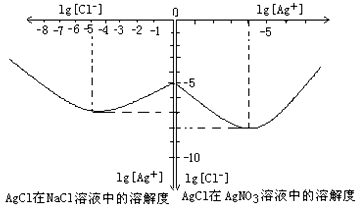
查看答案和解析>>
科目: 来源:浙江省模拟题 题型:填空题
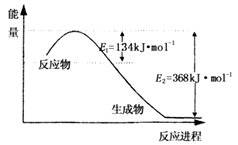
 2N2O5(g);已知体系中n(NO2)随时间变化如下表:
2N2O5(g);已知体系中n(NO2)随时间变化如下表: 
 2NH3(g)达到化学平衡状态的依据的是___________(填序号字母)。
2NH3(g)达到化学平衡状态的依据的是___________(填序号字母)。 查看答案和解析>>
科目: 来源:专项题 题型:填空题
 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。 
查看答案和解析>>
科目: 来源:0115 竞赛题 题型:单选题
 2SO3(g) △H = -196.6 kJ/mol 。现有SO2和O2各2mol,在恒温下的固定体积容器中反应,平衡时SO2的转化率为a,而在绝热密闭的同一反应容器中反应,平衡时SO2的转化率为b,则a与b的正确关系为
2SO3(g) △H = -196.6 kJ/mol 。现有SO2和O2各2mol,在恒温下的固定体积容器中反应,平衡时SO2的转化率为a,而在绝热密闭的同一反应容器中反应,平衡时SO2的转化率为b,则a与b的正确关系为 查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
 N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是
N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是 [ ]
查看答案和解析>>
科目: 来源:期末题 题型:单选题
 cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是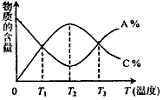
查看答案和解析>>
科目: 来源:浙江省模拟题 题型:填空题
 7N2+12H2O也可处理NO2。当转移12mol电子时,消耗的NO2在标准状况下是_________L。
7N2+12H2O也可处理NO2。当转移12mol电子时,消耗的NO2在标准状况下是_________L。 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol  2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol  SO3(g)+NO(g)的ΔH=____________kJ/mol。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。
SO3(g)+NO(g)的ΔH=____________kJ/mol。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。  CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________。 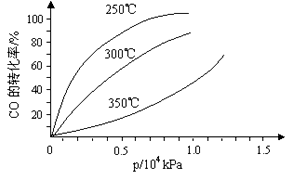
查看答案和解析>>
科目: 来源:浙江省模拟题 题型:单选题
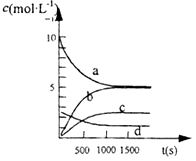
 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
查看答案和解析>>
科目: 来源:浙江省模拟题 题型:填空题
 H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1  H2NCOONH4(l) (氨基甲酸铵) △H1
H2NCOONH4(l) (氨基甲酸铵) △H1  H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com