
科目: 来源:山东省期中题 题型:单选题
 CO2(aq);△H= -19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
CO2(aq);△H= -19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是查看答案和解析>>
科目: 来源:山东省期中题 题型:单选题
 Si(s)+4HCl(g);△H=+QkJ/mol(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是查看答案和解析>>
科目: 来源:山东省期中题 题型:单选题
查看答案和解析>>
科目: 来源:山东省期中题 题型:单选题
 2B(g)+C(g)是放热反应,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是
2B(g)+C(g)是放热反应,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是查看答案和解析>>
科目: 来源:山东省期中题 题型:单选题
 nC(g)△H=Q,在不同条件下反应混合物中C的百分含量和反应过程与时间的关系曲线。下列有关叙述中一定正确的是
nC(g)△H=Q,在不同条件下反应混合物中C的百分含量和反应过程与时间的关系曲线。下列有关叙述中一定正确的是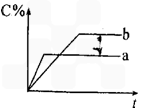
查看答案和解析>>
科目: 来源:辽宁省期中题 题型:单选题
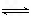 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示时间,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是:
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示时间,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是: 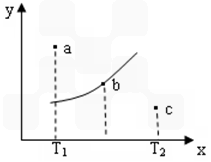
查看答案和解析>>
科目: 来源:辽宁省期中题 题型:填空题
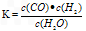
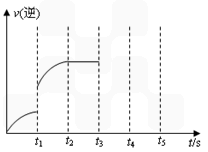
查看答案和解析>>
科目: 来源:湖南省同步题 题型:单选题
查看答案和解析>>
科目: 来源:湖南省同步题 题型:填空题
 2AB(g),可说明已达到化学平衡的是________ (填编号)
2AB(g),可说明已达到化学平衡的是________ (填编号) 查看答案和解析>>
科目: 来源:浙江省模拟题 题型:填空题
 2SO3(g);△H= -Q1KJ·mol-1
2SO3(g);△H= -Q1KJ·mol-1 2NO2(g);△H= -Q2KJ·mol-1
2NO2(g);△H= -Q2KJ·mol-1 SO3(g)+NO(g);△H= ________KJ·mol-1
SO3(g)+NO(g);△H= ________KJ·mol-1 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,则该反应△H= _____0 (填“>” 或“<” )。实际生产条件下控制在250℃、1.3×104kPa左右,选择此条件下的理由是__________ 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,则该反应△H= _____0 (填“>” 或“<” )。实际生产条件下控制在250℃、1.3×104kPa左右,选择此条件下的理由是__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com