
科目: 来源:不详 题型:填空题
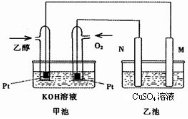
| ||
| ||
温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目: 来源:不详 题型:问答题

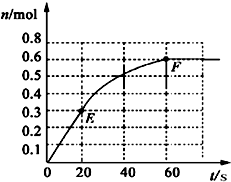
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:无锡一模 题型:单选题
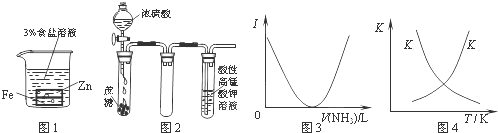
| A.图1:负极反应是Fe-2e-═Fe2+ |
| B.图2:酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| C.图3:可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I)的变化 |
| D.图4:可表示在恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g),△H<0”的平衡常数K正、K逆随温度的变化 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
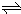
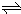
查看答案和解析>>
科目: 来源:不详 题型:问答题

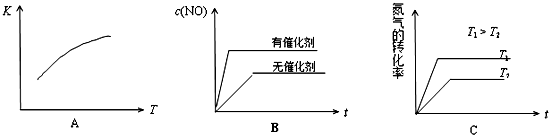
查看答案和解析>>
科目: 来源:不详 题型:问答题

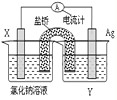
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:漳州二模 题型:填空题
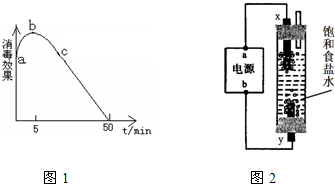
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 催化剂 |
| △ |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com