
科目: 来源:模拟题 题型:填空题
 SO2Cl2(l) △H = -97.3 kJ . mol-1
SO2Cl2(l) △H = -97.3 kJ . mol-1查看答案和解析>>
科目: 来源:专项题 题型:单选题
 FeO(s)+CO(g) △H=a kJ·mol-1;②Fe(s)+H2O(g)
FeO(s)+CO(g) △H=a kJ·mol-1;②Fe(s)+H2O(g) FeO(s)+H2(g) △H=b kJ·mol-1。以上两个反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下表
FeO(s)+H2(g) △H=b kJ·mol-1。以上两个反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下表
查看答案和解析>>
科目: 来源:专项题 题型:单选题
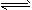 Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是
Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是 查看答案和解析>>
科目: 来源:山东省期中题 题型:单选题
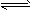 2NO(g),在2000℃时,K=6.2×10-4。2000℃时,在10L密闭容器内放入2.94×10-3mol NO、2.50×10-1mol N2和4.00×10-2mol O2,则下列说法正确的是
2NO(g),在2000℃时,K=6.2×10-4。2000℃时,在10L密闭容器内放入2.94×10-3mol NO、2.50×10-1mol N2和4.00×10-2mol O2,则下列说法正确的是 查看答案和解析>>
科目: 来源:0111 期中题 题型:填空题


查看答案和解析>>
科目: 来源:0113 期中题 题型:填空题
 2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据
2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据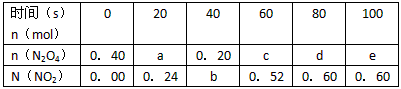
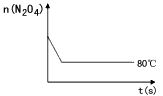
查看答案和解析>>
科目: 来源:河南省期中题 题型:计算题
 ,在2min时反应达到平衡状态,此时容器中剩余0.6mol B,并测得C的浓度为0.6 mol·L-1。计算:
,在2min时反应达到平衡状态,此时容器中剩余0.6mol B,并测得C的浓度为0.6 mol·L-1。计算:查看答案和解析>>
科目: 来源:广东省高考真题 题型:填空题
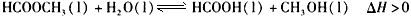
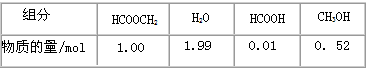

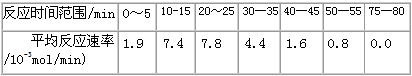
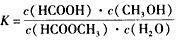 则该反应在温度T1下的K值为________________
则该反应在温度T1下的K值为________________ 查看答案和解析>>
科目: 来源:0110 期中题 题型:不定项选择题
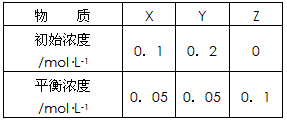
 2Z,其平衡常数为1600
2Z,其平衡常数为1600查看答案和解析>>
科目: 来源:江苏模拟题 题型:填空题


 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________。
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com