
科目: 来源:云南省期中题 题型:单选题
 4NO(g)+6H2O(g) ΔH=-905.9 kJ· mol-1,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-905.9 kJ· mol-1,下列叙述正确的是 v逆(NO)
v逆(NO)查看答案和解析>>
科目: 来源:0107 月考题 题型:单选题
 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
查看答案和解析>>
科目: 来源:期中题 题型:单选题
 CO(g)+Cl2(g);△H>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g);△H>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是查看答案和解析>>
科目: 来源:同步题 题型:填空题
 2HI(g) ΔH<0 反应中各物质的浓度随时间变化情况如图所示:
2HI(g) ΔH<0 反应中各物质的浓度随时间变化情况如图所示: 
查看答案和解析>>
科目: 来源:陕西省期中题 题型:单选题
 bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断 
查看答案和解析>>
科目: 来源:模拟题 题型:填空题

 CO(g)+2H2(g),此反应能自发进行的原因是___________________。
CO(g)+2H2(g),此反应能自发进行的原因是___________________。 

查看答案和解析>>
科目: 来源:期末题 题型:不定项选择题
 cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是
cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是 查看答案和解析>>
科目: 来源:期末题 题型:填空题
 N2(g)+ 3H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+ 3H2(g)。其中物质H2的物质的量变化如下图所示。 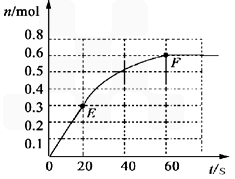
查看答案和解析>>
科目: 来源:同步题 题型:单选题
 2SO3(g);ΔH=-Q kJ/mol(Q>0)。下列说法正确的是
2SO3(g);ΔH=-Q kJ/mol(Q>0)。下列说法正确的是 查看答案和解析>>
科目: 来源:同步题 题型:单选题
 Ur-(尿酸根离子)+H3O+;
Ur-(尿酸根离子)+H3O+; NaUr(s)
NaUr(s)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com