
科目: 来源:河北省模拟题 题型:单选题
 2HI(g);△H<0,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是
2HI(g);△H<0,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是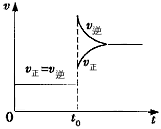
查看答案和解析>>
科目: 来源:河南省模拟题 题型:单选题
 W+Z,其他条件不变时,增大压强,正、逆反应速率(
W+Z,其他条件不变时,增大压强,正、逆反应速率(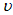 )变化的情况如图所示。下列对X、Y、W、Z 四种物质状态的描述正确的是
)变化的情况如图所示。下列对X、Y、W、Z 四种物质状态的描述正确的是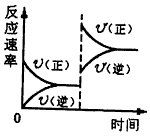
查看答案和解析>>
科目: 来源:0111 模拟题 题型:填空题
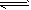 4NO2(g)+
4NO2(g)+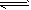 N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是查看答案和解析>>
科目: 来源:0103 模拟题 题型:单选题
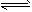 2SO3(g) 从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为
2SO3(g) 从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为查看答案和解析>>
科目: 来源:山东省模拟题 题型:单选题
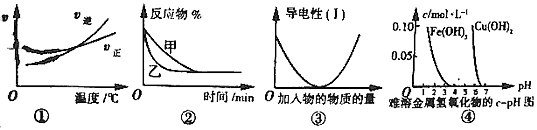
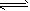 2AB3(g)的△H>0
2AB3(g)的△H>0  3C(g)+ D(s)的影响,乙的压强大
3C(g)+ D(s)的影响,乙的压强大查看答案和解析>>
科目: 来源:上海高考真题 题型:填空题
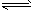 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表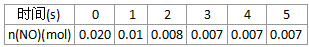
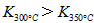 ,则改反应是_______热反应。
,则改反应是_______热反应。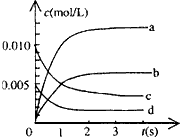
查看答案和解析>>
科目: 来源:山东省高考真题 题型:单选题
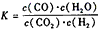 恒容时,温度升高,H2浓度减小。下列说法正确的是
恒容时,温度升高,H2浓度减小。下列说法正确的是 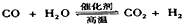
查看答案和解析>>
科目: 来源:重庆市高考真题 题型:填空题
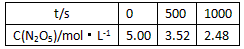
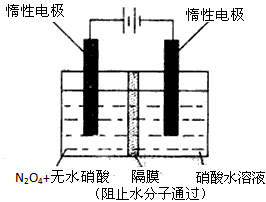
查看答案和解析>>
科目: 来源:北京模拟题 题型:单选题

 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 查看答案和解析>>
科目: 来源:陕西省模拟题 题型:填空题
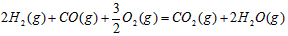
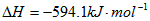 。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式_____________________;
。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式_____________________;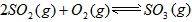 ,平衡混合体系中SO3的百分含量和温度的关系如图所示。 根据图示回答下列问题:
,平衡混合体系中SO3的百分含量和温度的关系如图所示。 根据图示回答下列问题: 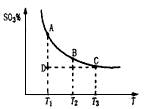
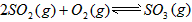 的△H_______0(填“>”或“<”);
的△H_______0(填“>”或“<”); 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com