
科目: 来源:2013-2014天津市高三第五次月考理综化学试卷(解析版) 题型:实验题
(18分)为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)实验过程如下:
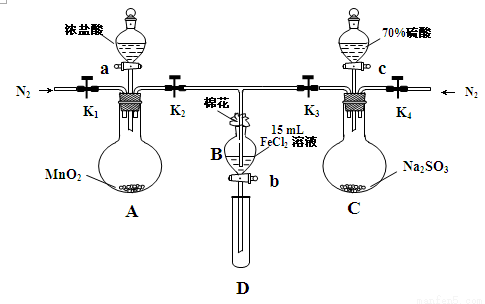
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为______________________。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)能说明氧化性Fe3+>SO2的离子方程式是______________________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(7)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液
颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
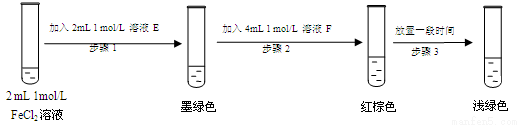
①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
查看答案和解析>>
科目: 来源:2013-2014天津市高三第五次月考理综化学试卷(解析版) 题型:填空题
(14分)甲醇、二甲醚等被称为绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚(CH3OCH3)。
(1)已知1g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为32kJ,请写出二甲醚燃烧热的热化学方程式____________________________________________________________________。
(2)写出二甲醚碱性燃料电池的负极电极反应式 __________________________________。
(3)用合成气制备二甲醚的反应原理为:2CO(g) + 4H2(g) CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图:
CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图:
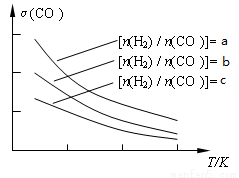
①a、b、c按从大到小的顺序排序为_________________,该反应的△H_______0(填“>”、“<”)。
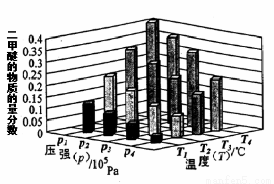
②某温度下,将2.0molCO(g)和4.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如上图所示,关于温度和压强的关系判断正确的是 ;
A. P3>P2,T3>T2 B. P1>P3,T1>T3 C. P2>P4,T4>T2 D. P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
A. 正反应速率先增大后减小 B. 逆反应速率先增大后减小
C. 化学平衡常数K值减小 D. 氢气的转化率减小
④ 某温度下,将4.0molCO和8.0molH2充入容积为2L的密闭容器中,反应达到平衡时,测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=__________。
查看答案和解析>>
科目: 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是
A.明矾[KAl(SO4)2.12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.变质的植物油有难闻的特殊气味,是由于植物油发生了酯化反应
C.浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果
D.海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化
查看答案和解析>>
科目: 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
关于原子结构、元素性质的说法正确的是
A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.在化学反应中,原子首先失去的电子能量最低
D.在元素周期表中,各主族元素的最高化合价与其族序数相等
查看答案和解析>>
科目: 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
B.金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步进行
C.工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质
D.Si、P、S、Cl相应的最高价氧化物对应水化物的酸性依次增强
查看答案和解析>>
科目: 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
仅用下表提供的仪器和药品,就能达到相应实验目的的是、
编号 | 仪器 | 药品 | 实验目的 |
A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量份数的NaCl溶液 |
B | 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 | 盐酸、大理石、碳酸钠溶液 | 证明非金属性:Cl>C>Si |
C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
D | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液,NaoH溶液 | 提纯混有MgCl2杂质的AlCl3溶液 |
查看答案和解析>>
科目: 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
有0.1 mol 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,C(CH3COO-)=C(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的C(CH3COO-)
C.溶液①、②等体积混合,混合液中c(CH3COO-)+ c(CH3COOH)= C(Na+)
D.溶液①、③等体积混合,混合液中C(Na+)>C(CH3COO-)> C(H+)>C(OH-)
查看答案和解析>>
科目: 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
一定条件下,碳钢腐蚀与溶液pH的关系如下:
pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
腐蚀快慢 | 较快 | 慢 | 较快 | ||||
主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
下列说法不正确的是
A.在pH<4溶液中 ,碳钢主要发生析氢腐蚀
B.存pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
查看答案和解析>>
科目: 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:简答题
(14分)已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
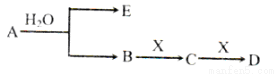
请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量, 产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
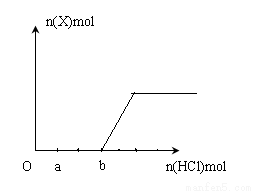
请回答:a点溶液中所含溶质的化学式为__________ ,b点溶液中各离子浓度由大到小的关系是_________________________________。
查看答案和解析>>
科目: 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:计算题
(18分)Heck反应是合成C--C键的有效方法之一,如反应

化合物II可由以F合成路线获得:
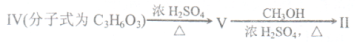
(1) Heck反应的反应类型是____反应;V→II的反应类型是_________反应
(2)化合物III的分子式为___________,1 mol化合物III最多可与_______mol H2发生加成反应。
(3)若化合物IV分子结构中有甲基,写出由化合物IV反应生成化合物V的化学方程式 ________________________________________________________.
(4)有关化合物II说法正确的是________________
A.l mol化合物II完全燃烧消耗5 mol O2
B.化合物II能使酸性高锰酸钾溶液褪色
C.化合物II难溶于水
D.化合物II分子间聚合,反应生成的高聚物结构为
(5)化合物III的一种同分异构体VI,苯环上的一氯取代物有两种,VI能与NaHCO3溶液反应生成无色气体,除苯环上的氢外核磁共振氢谱还有四组峰,峰面积之比为1:1:1:3,VI的结构简式为_______________________________.
(6) 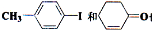 也可以发生类似反应①的反应,反应后有机产物的
也可以发生类似反应①的反应,反应后有机产物的
结构简式为_________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com