
科目: 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:填空题
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -113.0 kJ·mol-1
2NO2(g) △H= -113.0 kJ·mol-1
2SO2(g)+ O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为________。
②随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2  2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_______(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。如图是氯碱工业中电解饱和食盐水的原理示意图。
①电解饱和食盐水的化学方程式是 。
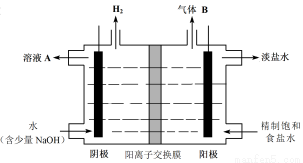
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是 。
查看答案和解析>>
科目: 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:填空题
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
开始沉淀时 | 1.5 | 3.4 | 6.3 |
完全沉淀时 | 2.8 | 4.7 | 8.3 |
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是 。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是 。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是 。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是 。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
查看答案和解析>>
科目: 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:实验题
某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
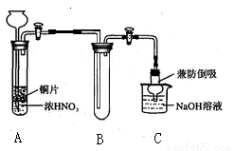
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:① 2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2 SO4+ 2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
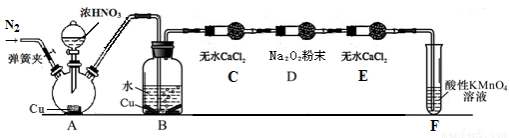
①B中观察到的主要现象是 ,F装置的作用是 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③充分反应后,检验D装置中发生反应的实验是 。
查看答案和解析>>
科目: 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
会生活密切相关,下列说法正确的是:( )
A. PM2.5是指空气中直径≤ 2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体(1μm =10 -6 m)
B.甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料
C.有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小,有磁性,这种碳与金刚石的关系是同素异形体
D.亚硝酸钠是有毒物质,不能添加到食物中
查看答案和解析>>
科目: 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
下列判断错误的是:( )
A.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHS04溶液混合,生成白色沉淀:Ba2++SO42?+H++OH? =BaSO4↓+H2O
B.常温下,等物质的量浓度的三种溶液①(NH4)2CO3;②NH4Cl;③(NH4)2Fe(SO4)2中c(NH4+):①<②<③
C.加入苯酚显紫色的溶液中:K+、NH4+、Cl-、I- 四种离子不能大量共存
D.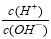 =1×10-12的溶液: K+、AlO2-、CO32-、Na+四种离子可以大量共存
=1×10-12的溶液: K+、AlO2-、CO32-、Na+四种离子可以大量共存
查看答案和解析>>
科目: 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
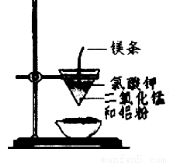
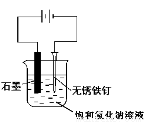
用下图所示装置进行实验,不能达到实验目的的是:( )

甲 乙

丙 丁
A.用甲装置比较硫、碳、硅三种元素的非金属性强弱
B.用乙装置可制得金属锰,用同样的装置可制得金属铬
C.用丙装置可实现对铁钉的保护
D.用丁装置验证铜与稀硝酸反应的气体产物只有NO
查看答案和解析>>
科目: 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是:( )
A.常温常压下,22.4 L乙烯中C—H键数为4 NA
B.1 mol羟基中电子数为10NA
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA
D.常温下,1 L 0.1 mol/L NH4NO3溶液中NH4+的数目小于6.02×1022
查看答案和解析>>
科目: 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1 盐酸和20.00 mL 0.1000 mol·L-1醋酸溶液,得到两条滴定曲线,如下图所示,若以HA表示酸,下列说法正确的是
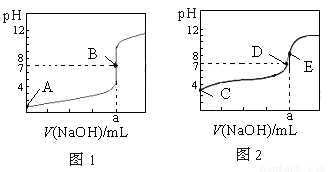
A.滴定盐酸的曲线是图2
B.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
C.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
D.当0 mL<V(NaOH)<20.00 mL时,对应混合液中各离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是:( )
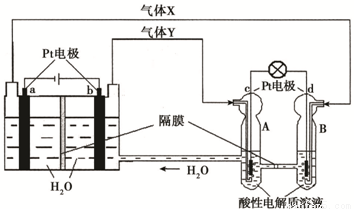
A.当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2
B.左端装置中化学能转化为电能,右端装置中电能转化为化学能
C.c极上发生的电极反应是:O2 + 2H2O + 4e- = 4OH—
D.d极上进行还原反应,右端装置B中的H+可以通过隔膜进入A
查看答案和解析>>
科目: 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:填空题
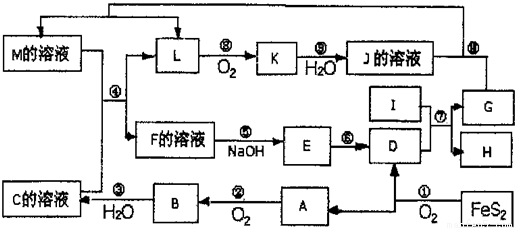
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体,过量G与J溶液反应生成M。
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(3)简述M溶液中阳离子的检验方法 。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。
(5)将化合物D与KNO3、KOH高温共熔,可制得一种“绿色”环保高效净水剂K2FeO4,同时还生成KNO2和H2O,该反应的化学方程式是_________________________。
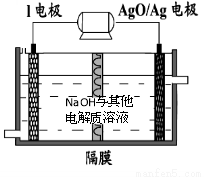
(6)镁与金属I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg与金属I的单质在一定温度下熔炼获得。
①熔炼制备该合金时通入氩气的目的是 。
② I电池性能优越,I-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com