
科目: 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 硫化亚铁与稀硝酸混合反应:2H++FeS=H2S↑+ Fe2+
B. 酸化NaIO3和NaI的混合溶液,滴入几滴淀粉溶液变蓝色:5I +IO3+6H+![]() 3I2+3H2O
3I2+3H2O
C. Ba(OH)2与等物质的量 NaHSO4混合:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 核内质子数为117、中子数为174的核素Ts可表示为:![]()
B. 甲烷分子的比例模型: ![]()
C. COCl2的结构式为:![]()
D. H2O2的电子式为:H+[ ![]() ]2-H+
]2-H+
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
实验 | 试剂 | 操作及现象 | ||
试管(I) | 试管(II) | |||
(试管容积为50 mL) | 实验a | 1.0 mol·L-1 FeSO4溶液 24 mL | 1.0 mol·L-1 Na2CO3溶液24mL | 倾倒完后,迅速用胶塞塞紧试管I的口部,反复上下颠倒摇匀,使反应物充分混合 反应过程中无气泡产生,生成白色絮状沉淀 放置1.5~2 h后,白色絮状沉淀转化为白色颗粒状沉淀 |
实验b | 1.0 mol·L-1 FeSO4溶液 10 mL | 1.0 mol·L-1 NaHCO3溶液 20 mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4 min后液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色 | |
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:__________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2O的质量为18g/mol
B. CH4的摩尔质量为16g
C. 3.01×1023个SO2分子的质量为32g
D. 标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组探究NO和Na2O2的反应,设计了如下图所示实验装置,其中E为实验前压瘪的气囊。
资料:除浅黄色的AgNO2难溶于水外,其余亚硝酸盐均易溶于水。
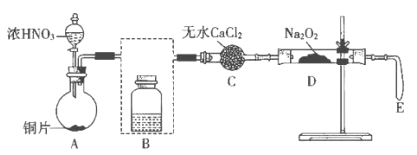
(1)写出A中反应的化学方程式:____________________________。
(2)将装置B补充完整,并标明试剂_____________。
(3)用无水CaCl2除去水蒸气的目的是_____________________________。
(4)反应一段时间后,D处有烫手的感觉,其中固体由淡黄色变为白色,直至颜色不再变化时,气囊E始终没有明显鼓起。
①学生依据反应现象和氧化还原反应规律推断固体产物为NaNO2。写出该反应的化学方程式:_________________________________。
②设计实验证明的NaNO2生成,实验方案是___________________________。(写出操作、现象和结论)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。
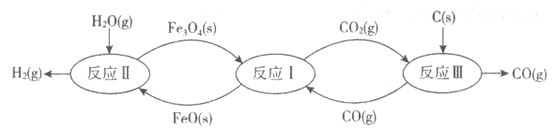
(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质能导电的是( )
①固体食盐 ②溴水 ③CuSO4·5H2O ④液溴⑤蔗糖 ⑥氯化氢气体 ⑦盐酸 ⑧液态氯化氢
A.①④⑤B.②⑦C.⑤⑥⑧D.④⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】氯是海水中含量最丰富的元素,氯的单质及其化合物在生成、生活领域应用广泛。
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为______________(用离子方程式表示)。
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以黄铁矿(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素(-1价)最终氧化成SO42-,写出制备二氧化氯的离子方程式_____________________________________。
(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。

生产漂白粉反应的化学方程式为_____________________。实际生产中,将石灰乳(含有3%-6%水分的熟石灰)从塔顶喷洒而下,氯气从塔的最底层通入。这样加料的目的是_____________________________。
(4)用莫尔法可以测定溶液中Cl-的含量。莫尔法是一种沉淀滴定法,用标准AgNO3溶液滴定待测液,以K2CrO4为指示剂,滴定终点的现象是溶液中出现砖红色沉淀(Ag2CrO4)。已知平衡Cr2O72-+H2O![]() 2CrO42-+2H+,该滴定过程需要控制pH范围在6.5~10.5,若pH小于6.5会使测定结果偏高。结合平衡移动原理解释偏高的原因:_______________________________ 。
2CrO42-+2H+,该滴定过程需要控制pH范围在6.5~10.5,若pH小于6.5会使测定结果偏高。结合平衡移动原理解释偏高的原因:_______________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:
甘油水蒸气重整 (SPG) | C3H8O3(1)+3H2O(g) | 反应I |
甘油部分氧化 (POG) | C3H8O3(1)+ | 反应II |
甘油氧化水蒸气 重整(OSRG) | C3H8O3(1)+ | 反应III |
(1)下列说法正确的是________(填字母序号)。
a. 消耗等量的甘油,反应I的产氢率最高
b. 消耗等量的甘油,反应Ⅱ的放热最显著
c. 经过计算得到反应Ⅲ的 △H3=-237.5 kJ·mol-1
d. 理论上,通过调控甘油、水蒸气、氧气的用量比例可以实现自热重整反应,即焓变约为0,这体现了科研工作者对吸热反应和放热反应的联合应用
(2)研究人员经过反复试验,实际生产中将反应Ⅲ设定在较高温度(600~700℃)进行,选择该温度范围的原因有:催化剂活性和选择性高、__________。
(3)研究人员发现,反应I的副产物很多,主要含有:CH4、C2H4、CO、CO2、CH3CHO,CH3COOH等,为了显著提高氢气的产率,采取以下两个措施。
①首要抑制产生甲烷的副反应。从原子利用率角度分析其原因:___________。
②用CaO吸附增强制氢。如图1所示,请解释加入CaO的原因:__________。

(4)制备高效的催化剂是这种制氢方法能大规模应用于工业的重要因素。通常将Ni分散在高比表面的载体(SiC、Al2O3、CeO2)上以提高催化效率。分别用三种催化剂进行实验,持续通入原料气,在一段时间内多次取样,绘制甘油转化率与时间的关系如图2所示。
①结合图2分析Ni/SiC催化剂具有的优点是_________。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(La2O3)可有效减少积碳。其反应机理包括两步:
第一步为:La2O3+CO2![]() La2O/span>2CO3
La2O/span>2CO3
第二步为:__________(写出化学反应方程式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com