
科目: 来源: 题型:
【题目】Ⅰ.ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
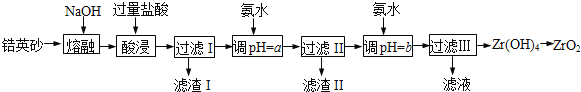
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为___________________________________________,滤渣I的化学式为___________________
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是____________________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为:________________________________________
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是:____________________________
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:___SiO2 + C + N2![]() Si3N4 + CO
Si3N4 + CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。__________
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30 mol氮气,反应生成了5 mol一氧化碳,则此时混合气体的平均摩尔质量是______________。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是__________(填序号)
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,浓度均为0.1molL-1的两种一元酸HX和HY溶液,用0.1molL-1的NaOH溶液分别进行滴定,滴定曲线如下图所示。下列有关叙述不正确的是


A. HX的酸性强于HY的酸性,且右图中m<1
B. 当![]() =1时,若两溶液同时升高温度,则c(Y-)/c(X-)减小
=1时,若两溶液同时升高温度,则c(Y-)/c(X-)减小
C. HY电离程度:b点大于a点
D. 当两溶液均呈中性时,c(X-)= c(Y-)
查看答案和解析>>
科目: 来源: 题型:
【题目】I.在现代有机化工生产中,通过天然气裂解所得某种主要成分,已成为制造合成纤维、人造橡胶、塑料的基石.其中相关物质间的转化关系如下图所示(C、G是两种常见的塑料,E的结构简式为![]() )
)
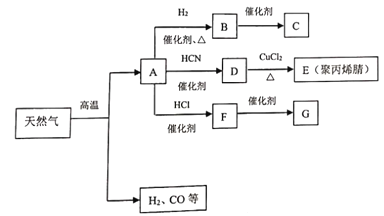
请回答下列问题:
(1)写出B的电子式_________。
(2)分别写出下列反应的化学方程式A→D______;F→G______。
II.为测定某有机化合物X的化学式. 进行如下实验;将0.15mo1有机物B和0.45mol O2在密闭容器中完全燃烧后的产物为CO2、CO、H2O(气),产物经过浓H2SO4后.质量增加8.1g,再通过灼热的氧化铜充分反应后,质量减轻2.4g,最后气体再通过碱石灰被完全吸收,质量增加19.8g. 试通过计算确定该有机物X的化学式(写出计算过程) _______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应2HI(g)![]() H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
H2(g) +I2(g)的能量变化如图所示。下列说法正确的是

A. 常温下,向体积为VL的容器中充入2mol HI(g)充分反应,可吸收12.5kJ的热量
B. 加入催化剂,分子的能量不变,但单位体积活化分子数增多,速率加快
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. H2(g) +I2(g)![]() 2HI(g)的活化能Ea为12.5kJ·mol1
2HI(g)的活化能Ea为12.5kJ·mol1
查看答案和解析>>
科目: 来源: 题型:
【题目】列有关金属腐蚀的说法中错误的是
A.纯银饰品久置表面变暗属于化学腐蚀
B.电化学腐蚀和化学腐蚀都是金属被氧化的过程,伴随有电流产生
C.金属发生的电化学腐蚀比化学腐蚀要普遍的多
D.温度越高,金属发生化学腐蚀的速率越快
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验乙烯性质的实验,请回答下列问题:

(1)A中碎瓷片的作用是________。
(2)B装置中反应的化学方程式为__________。
(3)C装置中可观察到的现象是_________。
(4)查阅资料.乙烯与酸性高锰酸钾溶液反应产生二氧化碳,根据本实验中装置_____(填装置字母)中的实验现象可判断该资料是否直实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是_______(填字母,下同),除去甲烷中乙烯的方法是___。
A 气体通入水中 B 气体通过盛溴水的洗气瓶
C 气体通过盛酸性高锰酸钾溶液的洗气瓶 D 气体通过氢氧化钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
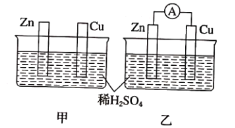
(1)以下叙述中,正确的是_______(填字母).
A 甲中锌片是负极,乙中铜片是正极 B 两烧杯中铜片表面均有气泡产生
C 两烧杯中溶液pH均增大 D 产生气泡的速度甲中比乙中慢
E 乙的外电路中电流方向Zn→Cu F 乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为_________;乙为________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是____。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:__________,当电路中转移0.25mo1电子时,消耗负极材料的质量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________
该反应中氧化剂是_____;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用如图所示装置制取少量乙酸乙酯。请回答下列问题:
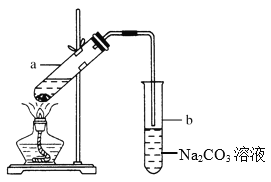
(1)试管a中需加入浓硫酸、乙酸各2 mL,乙醇3 mL,应该先加入________,最后加入________。
(2)试管a中发生反应的化学方程式是_____________,反应类型是_______,通常加入几片碎瓷片,其作用是_____________。
(3)反应结束后,振荡试管b,静置。观察到的现象是___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分。
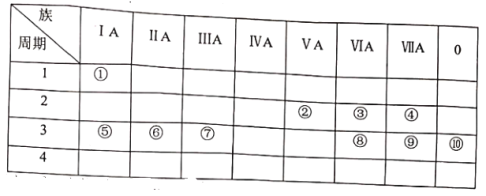
试用合适的化学用语回答下列问题:
(1)请画出元素④简单阴离子的结构示意图:____________。
(2) ③⑤⑧的原子半径由小到大的顺序为__________(填元素符号)。
(3)⑧和⑨的最高价氧化物对应水化物的酸性强弱为_____ > _____(填化学式)。
(4) ③⑤两种元素的原子按1:1组成的常见化合物的电子式 为_______。
(5)写出⑦的单质与⑤的最高价氧化物对应水化物溶液反应的化学方程式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com