
科目: 来源: 题型:
【题目】原子核外电子是分层排布的,下列关于L层与M层的说法不正确的是( )
A.L层离核比M层离核近
B.电子在M层上运动时所具有的能量高于L层
C.当L层上的电子数为奇数时,M层上不可能有电子
D.当L层上的电子数为偶数时,M层上一定有电子
查看答案和解析>>
科目: 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是__________(填“增大”“不变”或“减小”,以下相同)。
(2)将容器的体积缩小一半,其正反应速率__________,逆反应速率__________。
(3)保持体积不变,充入N2 使体系压强增大,其正反应速率__________,逆反应速率__________。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率__________,逆反应速率__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
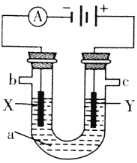
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中在X极附近观察到的现象是________。
②检验Y电极上电极反应产物的方法是________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①Y电极的材料是_______,电极反应式是_____。(说明:杂质发生的电极反应不必写出)
②当电路中有0.04mol电子通过时,阴极增重________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是
选项 | X | Y | Z | 对应过程的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①Na2CO3熔融 |
B | NaOH | NaHCO3 | Na2CO3 | ②加热 |
C | N2 | NO2 | HNO3 | ③加热 |
D | C | CO | CO2 | ④灼热炭粉 |
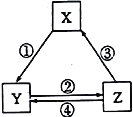
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
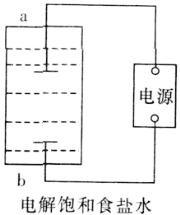
【题目】某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaClO;氯气与热的氢氧化钠溶液反应可生成NaClO和NaClO3。②在酸性较弱时KI只能被NaClO氧化,在酸性较强时亦能被NaClO3氧化。
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为_______(填“阳极”或“阴极”)。生成NaClO的离子方程式为________。
(2)该小组将0.784L(标准状况)Cl2通入50.00mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0mL。
Ⅰ.取稀释后的溶液25.00mL用醋酸酸化,加入过量KI溶液。用0.2000mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00mL时恰好到达终点。
Ⅱ.将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00mL。
①操作Ⅱ中氯酸钠与碘化钾反应的离子方程式为________。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中无机氮的循环过程可用如图表示。下列说法正确的是(已知:反应④的离子方程式为4NH4+ + 5O2![]() 2NO2- + 6H+ + N2O + 5H2O)
2NO2- + 6H+ + N2O + 5H2O)

A. ①②均属于固氮反应
B. 海洋中的反硝化作用一定需要氧气参加
C. 反应④中每生成1 mol H2O转移2 mol e-
D. 向海洋排放含NO3-的废水可能影响海洋中氮的循环
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com