
科目: 来源: 题型:
已知A、B、C、D、E是短周期原子序数依将增大的5种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物的难排于水。下列说法不正确的是 ( )
A.简单离子的半径:C>D>E>B
B.工业上常用电解法制得C和D的单质
C.稳定性: A2B>A2E
D.单质D可用于冶炼某些难熔金属
查看答案和解析>>
科目: 来源: 题型:
将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) ![]() 2HI(g) △H<0,并达到平衡,HI的体积分数ω(HI)随时间(t)变化如图(Ⅱ)所示。若改变反应条件,ω(HI)的变化如图(Ⅰ)所示,则改变的条件可能是
2HI(g) △H<0,并达到平衡,HI的体积分数ω(HI)随时间(t)变化如图(Ⅱ)所示。若改变反应条件,ω(HI)的变化如图(Ⅰ)所示,则改变的条件可能是

A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
查看答案和解析>>
科目: 来源: 题型:
工业上生产Mn02和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O![]()
下列说法不正确的是 ( )
A.①中MnO2和H2SO4都是氧化剂 B.①中析出16 g S时转移l mol电子
C.②中MnSO4发生氧化反应 D.硫酸在该生产中可循环利用
查看答案和解析>>
科目: 来源: 题型:
[选修物质结构与性质]
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式 ,F元素原子的电子排布式 ,E元素的原子结构示意图是 。
(2)化合物乙中含有的化学键是 。
(3)化合物甲为固体时属于 晶体,E单质在一定条件下与甲反应的化学方程式为 。
(4)如图立方体中心的“·”表示B单质所形成的原子晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的B原子
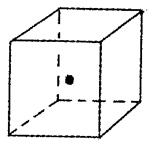
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式正确的是 ( )
A.氟气通入水中: 2F2+2H2O=4F-+4H++O2
B.向小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C.硫氢化钠溶液与碘反应:HS-+I2=S+2I-+H+
D.FeBr2溶液与足量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
查看答案和解析>>
科目: 来源: 题型:
关于下列各实验装置的叙述中,正确的是 ( )
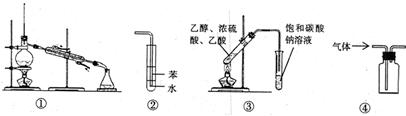
A.装置①常用于分离互不相溶的液体 B.装置②可用于吸收NH3
C.装置③可用于制备乙酸乙酯 D.装置④可用于收集NO、CO2等气体
查看答案和解析>>
科目: 来源: 题型:
下列叙述中正确的是 ( )
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HC1、HBr、Hl的稳定性依次增强
D.CS2、H2O、C2H2都是直线型分子
查看答案和解析>>
科目: 来源: 题型:
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:

(1)A的化学式为 。
(2)写出反应V的化学方程式 。
(3)写出反应VI的离子方程式为 。
(4)本工艺中可以循环利用的物质是(刚化学式表示) 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
查看答案和解析>>
科目: 来源: 题型:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
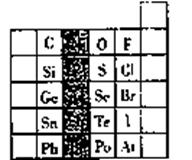
(1)阴影部分元素在元素周期表中的位置为第 族。根据元素周期律、预测;酸性强弱H2AsO4 H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为 ,在一定条件下,S与H??2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com