

科目: 来源: 题型:
设NA为阿伏加德罗常数,则下列说法中正确的是
A.常温常压下,1mol氨基(―NH2)所含有的电子总数为9NA
B.常温常压下,等体积等物质的量浓度的Na2S溶液和Na2SO4溶液的阳离子总数相等
C.在31g白磷分子中含有NA个P―P键
D.硬脂酸、软脂酸不是乙酸的同系物
查看答案和解析>>
科目: 来源: 题型:
下列叙述不正确的是
A.NH3易液化,液氨常用作制冷剂
B.与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C.铵盐受热易分解,因此贮存氮肥时要密封保存,并放在阴凉通风处
D.不能用稀HNO3和金属反应制取氢气
查看答案和解析>>
科目: 来源: 题型:
从海水中提取溴的反应原理是5NaBr + NaBrO3 + 3H2SO4 = 3Br2 + 3Na2SO4 + 3H2O,下列反应的原理与上述反应最相似的是
A 2NaBr + Cl2 = 2NaCl + Br2
B KClO3 + 6HCl ![]() KCl + 3Cl2↑ + 3H2O
KCl + 3Cl2↑ + 3H2O
C 2H2S + SO2 = 3S↓ + 2H2O
D AlCl3 + 3NaAlO2 + 6H2O = 4Al(OH)3↓ + 3NaCl
查看答案和解析>>
科目: 来源: 题型:
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。
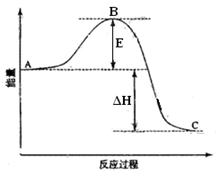
已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂加快速率,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H= 。
查看答案和解析>>
科目: 来源: 题型:
为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1 mol·L-1的KI溶液,滴加0.1 mol·L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为_____________、___________。
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想。
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
| 实验操作 | 现象 | 结论 |
| 步骤一: | 产生蓝色沉淀 | |
| 步骤二: | “猜想二”成立 |
查看答案和解析>>
科目: 来源: 题型:
如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是
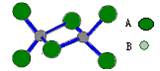
A.该化合物的化学式是Al2Cl6
B.该化合物是离子化合物,在熔融状态下能导电
C.该化合物在固态时所形成的晶体是分子晶体
D.该化合物中存在特殊的共价键,且不含有非极性共价键
查看答案和解析>>
科目: 来源: 题型:
工业生产粗硅的反应有:
SiO2+2C ![]() Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C ![]() SiC+2CO↑。
SiC+2CO↑。
(1)若产品中粗硅与碳化硅的物质的量之比为1∶1,则参加反应的C 和SiO2的质量比为______________。
(2)粗硅进一步制备纯硅的原理如下:
Si(粗)+2Cl2(g) ![]() SiCl4(l); SiCl4+2H2
SiCl4(l); SiCl4+2H2 ![]() Si(纯)+4HCl。
Si(纯)+4HCl。
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
(3)工业上还可以通过如下图所示的流程制取纯硅:
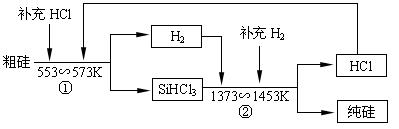
若反应①为:Si(粗)+3HCl(g)![]() SiHCl3(l)+H2(g);
SiHCl3(l)+H2(g);
则反应②的化学方程式为 ___________________________________ 。
假设每一轮次生产过程中,硅元素没有损失,反应①中HCl的利用率为α1,反应②中H2的利用率为α2,,若制备1mol纯硅,在第二轮次的生产中,现补充投入HCl和H2的物质的量之比是5∶1。则α1与α2的代数关系式为 ____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com