
科目: 来源: 题型:
A,B,C为第2或第3周期的元素,A、B在同周期,A、C阴离子分别为A2-和C-,
B2+ 和C-具有相同的电子层结构。下列说法中,正确的是
A.原子核外最外层电子数:A > C > B B.离子半径:A 2-> C- > B2+
C.B和C形成的化合物电子式为B2+ [ C ]![]() D.稳定性:H2A > HC
D.稳定性:H2A > HC
查看答案和解析>>
科目: 来源: 题型:
下列结论错误的是( )
①微粒半径:K+>Al3+>S2->C1- ②氢化物的稳定性:HF>HC1>H2S>PH3>SiH4
③离子的还原性:S2->C1->Br->I- ④氧化性:C12>S
⑤酸性:H2SO4>H3PO4>H2CO3 ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.只有① B.①③ C.②④⑤⑥⑦ D.①③⑤
查看答案和解析>>
科目: 来源: 题型:
北京时间2011年3月11日13时46分日本发生里氏9.0 级大地震,致使多处核电站爆炸,核辐射引发周边多国恐慌。其中![]() 是核电站最重要的工业原料,在自然界的丰度很低。下列有关
是核电站最重要的工业原料,在自然界的丰度很低。下列有关![]() 说法正确的是
说法正确的是
A.![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B.![]() 原子核外有143个电子
原子核外有143个电子
C.![]() 是
是![]() 的核素 D.
的核素 D.![]() 比
比![]() 少3个中子
少3个中子
查看答案和解析>>
科目: 来源: 题型:
据报道,卫生部决定从2011年5月1日起禁用面粉增白剂。资料显示,目前应用于
面粉的增白剂几乎全是过氧化苯甲酰,其合成路线如下,
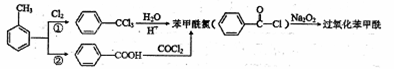
(1)过氧化苯甲酰的组成元素仅为C、H、O,其中氧的质量分数为26.45%,碳的质
量分数为69.42%,相对分子质量为242,通过计算和推理可知,过氧化苯甲酰的
结构简式为
(2)反应①所需的条件为 ,②的反应类型为
(3)苯甲酸有多种同分异构体,其中属于芳香族化合物的有 种(不含苯甲
![]() 酸)。
酸)。
(4)苯甲酰氯的同分异构体邻氯苯甲醛 可用于制备有机化工原料水杨酸
|
|
查看答案和解析>>
科目: 来源: 题型:
微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有10个电子;B溶
于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混
合后可得D和一种白色沉淀。![]() 离子与Ar原子的电子层结构相同。请回答:
离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是 。在A、B、C三种分子中,属于非极
性分子的有 (写化学式)。
(2)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型
 是 。
是 。
(3)构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,
右图立方体中心的“![]() ”表示该晶体中的一个原子,请在该立方体的顶点上
”表示该晶体中的一个原子,请在该立方体的顶点上
用“![]() ”表示出与之紧邻的原子。
”表示出与之紧邻的原子。
(4)光谱证实F与烧碱溶液反应有![]() 生成,则
生成,则![]() 中不存在 (填字母)。
中不存在 (填字母)。
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.![]() 键 h.
键 h.![]() 键
键
查看答案和解析>>
科目: 来源: 题型:
空气吹出法工艺是目前"海水提溴"的主要方法之一。其工艺流程如下:
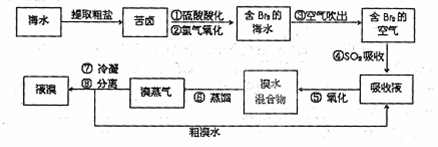
(1)步骤①中用硫酸酸化可提高![]() 的利用率,其原因是
的利用率,其原因是
(2)步骤⑥的蒸馏过程中,溴出口温度为何要控制在80℃—90℃。温度过高或过低都不
利于生产 ;请解释原因
(3)步骤⑦冷凝后得到液溴与溴水的混合物,可利用它们相对密度相差很大的特点进行
分离。步骤⑧若在实验室中进行,所用仪器的名称是 ,分离时液溴从分离器
的 (填“上口”或“下□”)排出。
(4)不直接用“含 ![]() 的海水”进行蒸馏得到液溴,而是经过③、④、⑤的操作,原因
的海水”进行蒸馏得到液溴,而是经过③、④、⑤的操作,原因
是 。
查看答案和解析>>
科目: 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等杂质离子,实验室提纯
等杂质离子,实验室提纯![]() 的
的
流程如下:
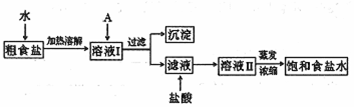
提供的试剂:饱和![]() 溶液 饱和
溶液 饱和![]() 溶液
溶液 ![]() 溶液 BaCl2溶液
溶液 BaCl2溶液
![]() 溶液
溶液
①欲除去溶液Ⅰ中的![]() 、
、![]() 、
、![]() 、
、![]() 离子,选出A所代表的试剂,按滴加顺
离子,选出A所代表的试剂,按滴加顺
序依次为 (只填化学式)。
②加盐酸的目的是(用离子方程式表示) 。
(2)某化学小组拟采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并用电解产
生的![]() 还原
还原![]() 粉末来测定Cu的相对原子质量,同时验证氯气的氧化性。
粉末来测定Cu的相对原子质量,同时验证氯气的氧化性。
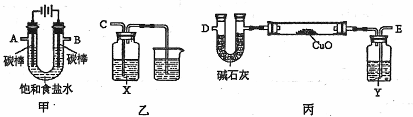
①写出甲中反应的化学方程式 。
②为完成上述实验,正确的连接顺序为A连 ,B连 (填接口字母)。
③乙装置中X试剂可以是 ,丙装置中Y试剂的作用是 。
④测定Cu的相对原子质量。
将![]() g
g![]() 置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量。
置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量。
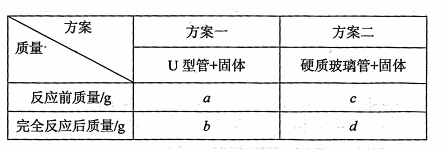
请回答:
你认为方案 较佳,另一个方案得到的Cu的相对原子质量会 (填“偏
低”、“偏高”)。按较佳方案计算,得到Cu的相对原子质量是 。
查看答案和解析>>
科目: 来源: 题型:
自然界中氮的循环涉及到地球上生物圈的方方面面。人类进入工业化社会以后,化学合成氮肥的数量迅速上升,对氮的循环和环境影响很大。下图是工业合成氮肥的转化关系:
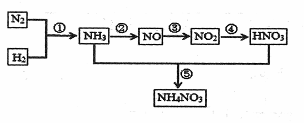
回答下列问题:
(1)反应①的条件是 ,反应④的化学方程式为 ,
反应⑤所得产物的溶液中离子浓度由大到小得顾序为 。
(2)实验室制取NH3的一种方法是在生石灰中滴加浓氨水,其原因是
。
(3)硝酸厂的尾气含有氮的氧化物,直接排放将污染空气。目前科学家探索利用燃料
气体中的CH4等将氮的氧化物还原为N2和H2O,反应原理为:
![]()
![]()
则![]() 直接将NO2还原为N2的热化学方程式为 。 .
直接将NO2还原为N2的热化学方程式为 。 .
(4)下图表示某温度时,反应N2O4(g)![]() 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进
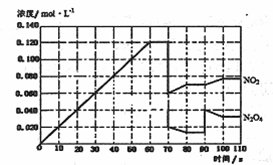
①此反应的平衡常数表达式K= 。
②反应进行到70s时,改变的条件可能是 (填字母) , 反应进行到90s时,改变的条件可能是 (填字母)
A.加入催化剂 B.扩大容器体积 C.升高温度 D.增大N2O4的浓度
③请在图中画出反应物N2O4在0~70秒时的浓度变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com