
科目: 来源: 题型:
【化学—有机化学基础】
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。
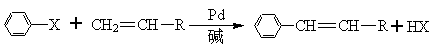 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)
经由Heck反应合成M(一种防晒剂)的路线如下:
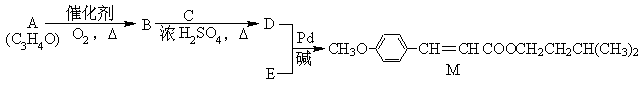
回答下列问题:
(1)M可发生的反应类型是______________。
a.取代反应 b.酯化反应 c.缩聚反应 d.加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是__________。
D在一定条件下反应生成高分子化合物G,G的结构简式是__________。
(3)在A → B的反应中,检验A是否反应完全的试剂是_______________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【化学—物质结构与性质】
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为______个。
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为______________________________。
HO―![]() ―CHO的沸点比
―CHO的沸点比![]() 高,原因是______________________________。
高,原因是______________________________。
(3) H+可与H2O形成H3O+,H3O+中O原子采用_________杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为____________________________________。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为a g•cm-3,NA表示阿伏伽德罗常数,则CaO晶胞体积为________cm3。
查看答案和解析>>
科目: 来源: 题型:
【化学-化学与技术】
水处理技术在生产、生活中应用广泛。
(1)含有较多____________离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为(写一个即可)
____________________________________
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过______(填“RH”或“ROH”)型离子交换树脂,原因是____________________________________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为__________ _________________。电渗析法净化水时,使离子通过半透膜的推动力是__________。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的______________________________。
查看答案和解析>>
科目: 来源: 题型:
实验室以含有Ca2+、Mg2+、Cl‾、SO42‾、Br‾等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
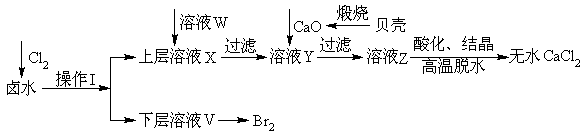
(1)操作I使用的试剂是______________,所用主要仪器的名称是__________________。
(2)加入溶液W的目的是____________________________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择pH最大范围是__________________。酸化溶液Z时,使用的试剂为____________。
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | C(OH‾)=1.8 mol•L‾1 |
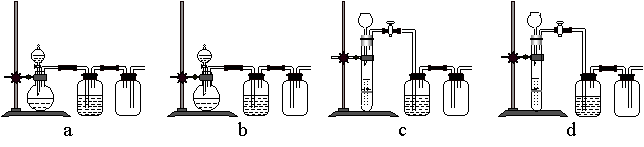
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是______。
(4)常温下,H2SO3的电离常数Ka1=1.2×10‾2,Ka2=6.3×10‾8,H2CO3 的电离常数Ka1=4.5×10‾7,Ka2=4.7×10‾12。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于__________________。
设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论,仪器自选)。
供选的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHCO3、蒸馏水、饱和石灰水、酸性 溶液、品红溶液、pH试纸。
_______________________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
科研、生产中常涉及钠、硫及其化合物。
 (1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为___________________________________。要清洗附着在试管壁上的硫,可用的试剂是________。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为___________________________________。要清洗附着在试管壁上的硫,可用的试剂是________。
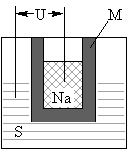
(2)右图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为______________________。M(由Na2O和Al2O3制得)的两个作用是_______________________、_______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的_______倍。
(3)Na2S溶液中离子浓度由大到小的顺序为________________________________,向该溶液中加入少量固体CuSO4,溶液pH________(填“增大”“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为_______________________________(用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________________________________。利用反应6NO2+8NH3 ![]() 7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是__________L。
7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是__________L。
 (2)已知:2SO2(g)+O2(g)
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
一定条件下,将NO2与SO2以体积比1︰2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1︰6,则平衡常数K=__________________。
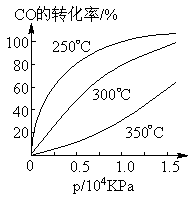
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_________________________________。
查看答案和解析>>
科目: 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定的关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后即对铁制品失去保护作用
查看答案和解析>>
科目: 来源: 题型:
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少 B.溶液中![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大 D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com