

科目: 来源: 题型:
下列四种元素中,其单质的氧化性最强的是 ( )
A.基态原子含有未成对电子最多的第三周期元素
B.位于元素周期表中第三周期第ⅢA族的元素
C.基态原子最外层电子排布为2s22p6的元素
D.基态原子最外层电子排布为3s23p5的元素
查看答案和解析>>
科目: 来源: 题型:
下列叙述中正确的是( )
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.NaCl和CsCl晶体中阳离子的配位数都是6
D.CS2、H2O、C2H2都是直线型分子
查看答案和解析>>
科目: 来源: 题型:
已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是( )
A.HMnO4 B.H2SeO3 C.H3BO3 D.H3PO4
查看答案和解析>>
科目: 来源: 题型:
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
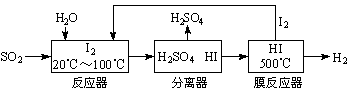
请回答下列问题:
(1) 已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为____________________________________________________。
(2) 该循环工艺过程的总反应方程式为______________________________________。
(3) 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是______ _____________________________________________________________________。
(4) 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH) + MH![]() Ni(OH)2 + M
Ni(OH)2 + M
①电池放电时,负极的电极反应式为_________________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为___________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知:
CH2=CH-CH=CH2+R-CH=CH-R′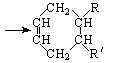 (可表示为
(可表示为![]() )
)
其中,R、R′表示原子或原子团。
A、B、C、D、E、F分别代表一种有机物,F的相对分子质量为278,其转化关系如下图所示(其它反应物、产物及反应条件略去):
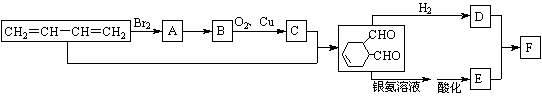
请回答下列问题:
(1) ![]() 中含氧官能团的名称是____________________。
中含氧官能团的名称是____________________。
(2) A反应生成B需要的无机试剂是__________________。上图所示反应中属于加成反应的共有______个。
(3) B与O2反应生成C的化学方程式为______________________________________。
(4) F的结构简式为__________________________。
(5) 写出含有HC≡C-、氧原子不与碳碳双键和碳碳三键直接相连、呈链状结构的C物质的所有同分异构体的结构简式:_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1) 铁含量的测定
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO![]() 被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO![]() 被还原成Mn2+。
被还原成Mn2+。
重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液19.98 mL。
请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、__________、转移、洗涤并转移、__________、摇匀。
② 加入锌粉的目的是____________________。
③ 写出步骤三中发生反应的离子方程式:____________________________________。
④ 实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4溶液的量不够,则测得的铁含量__________。(选填“偏低”、“偏高”、“不变”)
(2) 结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误:__________________________________________;________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com