
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是




A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0

下列分析中正确的是
A.图Ⅰ研究中的是t0时增大反应物浓度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且甲的温度较高
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
现有物质的量浓度均为0.1 mol/L的下列5种物质的水溶液:①HNO3 ②H2SO4③CH3COOH ④ NaOH其溶液中由水电离出的c(H+)的大小关系是
A. ③>①=④>② B. ③=①=④>②
C. ②>①>③>④ D. ③>①>④>②
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
化学反应C(s)+H2O(g) CO(g)+H2(g) △H>0达到平衡,下列叙述正确的是
CO(g)+H2(g) △H>0达到平衡,下列叙述正确的是
A.减小压强,平衡向正反应方向移动
B.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.加入水蒸气使容器压强增大,平衡向逆反应方向移动
D.加入固体碳,平衡向正反应方向移动
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
在相同温度下,100mL 0.01mol/L醋酸与10mL 0.1mol/L醋酸相比,下列数值前者大于后者的是
A.中和时所需NaOH的量 B.电离程度 C.H+浓度 D.醋酸的物质的量
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
在密闭容器中发生反应aA(g)  cC(g)+dD(g)达平衡后,保持温度不变,将容器体积压缩到原来的一半。当达到新的平衡时,D的浓度为原平衡时的1.6倍,则
cC(g)+dD(g)达平衡后,保持温度不变,将容器体积压缩到原来的一半。当达到新的平衡时,D的浓度为原平衡时的1.6倍,则
A.平衡向正反应方向移动 B. A的转化率变小
C. D体积分数变大 D. a>c+d
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2==O2+HbCO ,37 ℃时,该反应的平衡常数K=220 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
A.CO与HbO2反应的平衡常数K=/
 B.人体吸入的CO越多,与血红蛋白结合的O2越少
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
 D.把CO中毒的病人放入氧仓中解毒,其原理是使上述平衡向左移动
D.把CO中毒的病人放入氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( )
|
测定时刻/s |
t1 |
t2 |
t3 |
t4 |
|
c(A)/(mol·L-1) |
6 |
3 |
2 |
2 |
|
c(B)/(mol·L-1) |
5 |
3.5 |
3 |
3 |
|
c(C)/(mol·L-1) |
1 |
2.5 |
3 |
3 |
A.在t3 时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为2A+B? ?2C
?2C
D.在t2~t3内A的平均反应速率为1mol·L-1·s-1
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:有关该电池的说法正确的是
Cd + 2NiOOH + 2H2O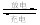 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
A.充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(9分)
(1)家用液化气的主要成分之一是丁烷(C4H10),当1 kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:
(2)已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
现有0.2 mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H=—24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5 kJ·mol-1
写出CO(g)还原FeO(s)得到Fe (s)体和CO2(g)的热化学反应方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com