

科目: 来源:高中化学新课标鲁科版 必修Ⅱ 鲁科版 题型:058
某高二化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
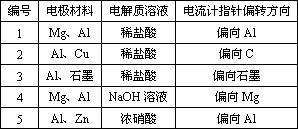
根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同?答:________.
(2)写出实验3中的电极反应式和电池总反应方程式.
铝为(________)________;石墨为(________)________;电池总反应:________.
(3)实验4中的铝作正极还是负极?
答:________,为什么?
答:________.
写出铝电极的电极反应式________.
(4)解释实验5中电流计指针偏向铝的原因:________.
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受到哪些因素的影响?
查看答案和解析>>
科目: 来源:导学大课堂必修二化学人教版 人教版 题型:058
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:导学大课堂必修一化学人教版 人教版 题型:058
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是______________.
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.

这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号)________→________→________→________.
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是________,B瓶溶液的作用是________,C瓶溶液的作用是________.
(4)装置②中所加固体药品是________,可验证的产物是________,确定装置②在整套装置中位置的理由是________.
(5)装置③中所盛溶液是________,可验证的产物是________.
查看答案和解析>>
科目: 来源:河南省清丰一高2009-2010学年高二上学期期末考试化学试题 题型:058
实验室里配制了0.1 mol·L-1的盐酸和0.1 mol·L-1的氨水两种溶液.试回答下列问题:
(1)在25℃时,0.1 mol·L-1的盐酸中的C(OH-)=________.
(2)在25℃时,已知氨水的电离平衡常数为Kb=1.7×10-5 mol·L-1,1.3×1.3=1.7,则当0.1 mol·L-1的氨水在该温度下达到电离平衡时,溶液中的C(OH-)=________;写出一水合氨的电离方程式:________.
(3)在25℃时,将0.1 mol·L-1的盐酸和0.1 mol·L-1的氨水两种溶液等体积混合,所得溶液的pH________7(填“大于”、“小于”或“等于”),原因是(用离子方程式表示)________;所得溶液中各离子的浓度由大到小的顺序是________.
查看答案和解析>>
科目: 来源:湖南省宜章一中2009-2010学年高二上学期期中考试化学试题 A 题型:058
某学生进行淀粉水解实验,并检验水解产物中是否含有葡萄糖.该生拟定如下操作:
A.取一只试管制取Cu(OH)2沉淀备用;
B.再加入3 ml~5 ml H2SO4;
C.加入NaOH溶液中和其中的硫酸;
D.把氢氧化铜沉淀加入溶液中;
E.加热煮沸几分钟;
F.加热至沸,观察之;
H.取一支试管加入少量淀粉溶液.
(1)从上述操作中选择必要的若干步,按实验正确顺序填入下列空格中:
A-( )-( )-( )-( )-( )-( )
(2)写出淀粉水解的化学方程式____________________.
查看答案和解析>>
科目: 来源:必修一导学指导化学苏教版 苏教版 题型:058
工业上测量SO2、N2和O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O![]() H2SO4+2HI.
H2SO4+2HI.

(1)混合气体进入反应管后,量气管内增加的水的体积等于________(填写气体的化学式)的体积.
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得SO2的含量________(填“偏高”“偏低”或“不受影响”).
(3)反应管内的碘的淀粉溶液也可以用________(填写物质名称)代替.
(4)若碘溶液体积为Va mL,浓度为c mol·L-1,N2与O2的体积为Vb mL(已折算为标准状况下的体积).用c、Va、Vb表示SO2的体积分数为________.
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为________(选下列仪器的编号).
a.烧杯
b.试管
c.广口杯
d.容量瓶
e.量筒
f.单孔塞
g.双孔塞
查看答案和解析>>
科目: 来源: 题型:058
某学生测定硫酸铜结晶水含量时:
(1)某次实验所得数据:
加热前质量/g 加热后质量/g
容器 容器+晶体 容器+无水CuSO4
W1 W2 W3
写出所得结晶水含量(x%)的计算公式:____________________________________。
(2)实验时至少要进行几次称量操作?________。为何有时不得不多进行一次称量操作?________________________________________。
(3)若CuSO4×5H2O晶体中含有Na2SO4×10H2O,结果测得结晶水含量为180/411,则混合物中CuSO4×5H2O与Na2SO4×10H2O的物质的量之比为____________。
查看答案和解析>>
科目: 来源: 题型:058
如图是接触法制硫酸的模拟实验装置图。

根据图回答:蒸馏烧瓶中放有________;分液漏斗中装________;硅胶的作用是________;圆底烧瓶中固体物质是________;装有H2O的试管内产生的现象和原因是________;最后一烧杯中应放的物质和作用是________。
查看答案和解析>>
科目: 来源: 题型:058
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净Fe(OH)2沉淀。应用如图电解实验可制得白色的纯净Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
(1)a电极材料应为________,电极反应式为________。
(2)电解液c可以是(填编号)________。
A.纯水 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为________,在加入苯之前,对c应作何简单处理?________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)________。
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减少两电极间距离 D.适当降低电解液的温度

查看答案和解析>>
科目: 来源: 题型:058
根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写)_________。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒
C.坩埚 H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是_________。
(2)某学生实验后得到以下数据:
加热前质量 加热后质量
W1(容器) W2(容器+晶体) W3(容器+无水硫酸铜)
5.4g 7.9g 6.8g
请写出结晶水含量WH2o的计算公式(用W1,W2,W3表示)________;该学生测定结果是偏高还是偏低?________,从下列分析中选出该学生实验误差的原因可能是(填写字母)________。
A.加热前称量时容器未完全干燥
B.最后两次加热后的质量相差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却
D.加热过程中有少量晶体溅失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com