

科目: 来源:活题巧解巧练·高考化学(第一轮) 题型:058
某课外活动小组试用电解法根据电极上析出物质的质量来测定铜的相对原子质量,其实验原理为:电解硫酸铜溶液时Cu2+在电极上放电析出,根据析出Cu的质量计算其相对原子质量.已知在测定过程中溶液中c(Cu2+)以保持不变为宜.试回答:
(1)选择电极材料,画出装置示意图.
(2)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是:________(选填下列操作步骤的编号)
①称量电解前电极质量,②刮下电解后电极上的铜并清洗,
③用蒸馏水清洗电解后的电极,④低温烘干电极后称量,
⑤低温烘干刮下的铜后称量,⑥再次低温烘干后称量至恒重.
(3)若电流强度为I A,通电时间为t s后,精确测得电极上析出的铜的质量为m g.已知电子的电量为e C,阿伏加德罗常数为NA.试列出铜的相对原子质量的计算表达式:Mr(Cu)=________.
查看答案和解析>>
科目: 来源:江苏省阜宁县中学2011-2012学年高二下学期期中调研考试化学试题 题型:058
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:广东省惠州一中、深圳高级中学2011-2012学年高一下学期期末联考化学试题 题型:058
(1)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极.接通电源后,甲中现象是b电极上产生刺激性气味气体.据此回答问题:

①电源的N端为________极;
②电极c上的现象为________;
③乙中总反应的化学方程式为________;
④往甲中加入________,可使溶液恢复原状.
如果乙装置电解过程中铜全部析出,此时电解能不能继续进行(填“能”、“不能”)________.
(2)臭氧是常见的强氧化剂.制取臭氧的方法之一是电解纯水(原理如下图).
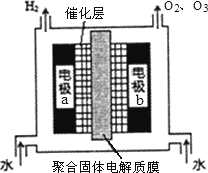
①电极a为________极(填“阴”或“阳”)
②写出电极b生成臭氧的电极反应式________;电极b附近的溶液呈________性(填“酸”或“碱”).
查看答案和解析>>
科目: 来源:吉林省长春市十一高2011-2012学年高一下学期期中考试化学试题 题型:058
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
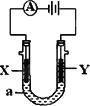
(1)若X、Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式为________.在X极附近观察到的现象是________.
②电解总反应离子方程式为________.
(2)要在铁件的表面镀铜防止铁被腐蚀,则:
①Y电极的材料是________(选填纯铁、纯铜或纯锌),电极反应式是________.电解液a选用________溶液,电解过程中其浓度________(选填增大、减小或不变).
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol.
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:________.
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三上学期12月练习化学试题 题型:058
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图.
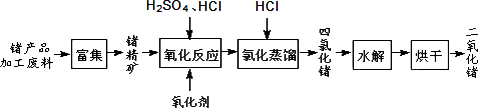
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:________.
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:________.
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为:________.温度对GeCl4的水解率产生的影响如图所示.为控制最佳的反应温度,实验时可采取的措施为________.(填字母)

A.用冰水混合物
B.49℃水浴
C.用冰盐水
(4)根据下表中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH变化的原因________,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应________.
![]()
查看答案和解析>>
科目: 来源:山东省潍坊市三县2011-2012学年高二上学期模块学分认定检测化学试题 题型:058
海水是人类资源的宝库,“海水晒盐”是获取食盐的重要来源.食盐既是一种生活必需品,也是一种重要的工业原料.以食盐为原料可以得到多种产品.
(1)工业上用NaCl制备金属钠的化学方程式是________.
(2)工业上主要通过电解饱和氯化钠溶液的方法获得氢氧化钠.
①该过程中阴极的产物是________;阴极反应为:________
②阳极反应式为________,检验该电极反应产物的方法是:________.
③当阴极上收集到标准状况下气体22.4 L时(假设产生的气体完全被收集),则电路中通过电子的数目为________NA.
(3)电解氯化钠稀溶液可以制备“84”消毒液,若通电时产生的氯气被溶液完全吸收,且最终所得消毒液仅含一种溶质,请写出相应的化学方程式:________(用一个方程式表示).
(4)海水电解制得的氢气用于合成氨,某合成氨厂生产流程如下:
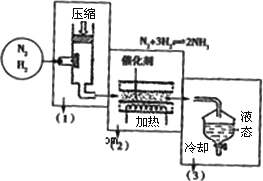
①在第(1)个设备中先把N2 、H2压缩的目的是:________.
②在第(3)个设备中用冷却的方法分离出________其目的是:________.
查看答案和解析>>
科目: 来源:吉林省长春十一中2010-2011学年高二上学期期末考试化学试题 题型:058
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).
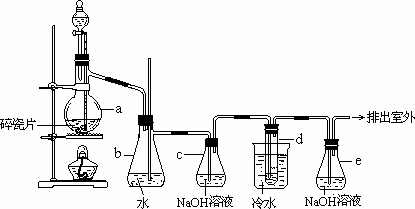
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式.
________
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请
写出发生堵塞时瓶b中的现象.________.
(3)容器c中NaOH溶液的作用是:________.
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多.如果装置的气密性没有问题,试分析其可能的原因.________
查看答案和解析>>
科目: 来源:陕西省礼泉一中2012届高三上学期期末考试化学试题 题型:058
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究.
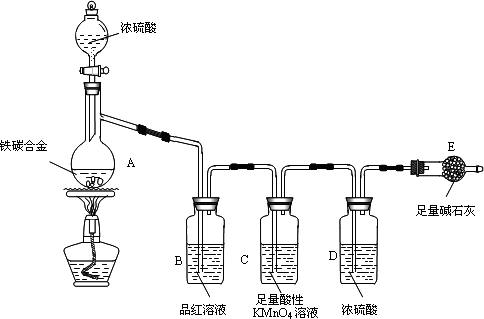
Ⅰ测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后________,则证明装置的气密性良好.
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g.铁碳合金中铁的质量分数为________(写表达式).
(3)装置C的作用________.
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大.你认为改进的方法是________.
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高.你认为其中的原因是________.
Ⅱ探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:________.
(7)A中铁与浓硫酸发生反应的化学方程式是________.
查看答案和解析>>
科目: 来源:山西省太原五中2011-2012学年高二上学期期末检测化学理科试题 题型:058
三氯化铁是中学化学实验室中必不可少的重要试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,充分反应后溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3挥发,再降温结晶得FeCl3·6H2O晶体.填写下列空白:
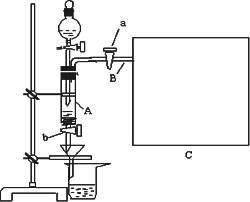
(1)滴加盐酸,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是________;
(2)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸干溶液的方法来制得晶体的理由________;
(3)用该法制得的晶体中往往混有Fe(NO3)3,为了制得较纯净的FeCl3·6H2O,可将烧杯内的稀硝酸换成________;
(4)若要求废铁屑的纯度,需要测出从B中排出气体的体积.若测得排出的气体体积为V(已折算成标准状况,单位:L),则废铁屑的纯度为________(用m、V的代数式表示);
(5)为了测出从B中放出气体的体积V,请自选仪器在C处设计简便、合理的集气装置,并在上面框格中画出该装置图(假设所用仪器的体积均足够大).
查看答案和解析>>
科目: 来源:湖南省雅礼中学2011届高三第一次月考化学试题 题型:058
某同学为了研究乙酸的性质,进行了如下实验:
(一)该同学利用下图所示的仪器和药品,设计了一个简单的一次性完成实验装置,来验证乙酸、碳酸和苯酚溶液酸性强弱.

(1)实验装置的连接顺序是:A→________→________→________→C→________→________→________→________→J
(2)写出实验中能说明碳酸比苯酚的酸性强的化学方程式________.
(二)为了研究乙酸的酯化反应,该同学进行了如下实验,步骤如下:在园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:
(1)反应中浓硫酸做________剂和吸水剂(或脱水剂).
(2)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加醋酸,边加热蒸馏.这样操作可以提高酯的产率,其原因是________.
(3)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图.若需要在图中圆括号内填入适当试剂,在方括号内填入适当分离方法.

下列试剂和分离方法正确的是________.
A.试剂a是氢氧化钠溶液,试剂b是稀硫酸;分离方法①是蒸馏,分离方法②是分液,分离方法③是蒸馏
B.试剂a是饱和碳酸钠溶液,试剂b是稀硫酸;分离方法①是分液,分离方法②是蒸馏,分离方法③是蒸馏
C.试剂a是饱和碳酸钠溶液,试剂b是稀硝酸;分离方法①是过滤,分离方法②是分液,分离方法③是蒸馏
D.试剂a是氢氧化钠溶液,试剂b是盐酸;分离方法①是分液,分离方法②是蒸馏,分离方法③是分液
(4)该同学在查阅资料时发现,乙酸和乙醇的酯化反应是分两步反应进行的,其反应的过程如下:
CH3COOH+HOC2H5 CH3COOC2H5+H2O
CH3COOC2H5+H2O
a.你认为其中属于加成反应的是________(填反应序号,在①②③④中选取)
b.在有机羧酸和醇的酯化反应中,脱水时,羧酸脱________基.为了探究酯化反应中的脱水方式,一般采取同位素示踪法,你认为用18O同位素进行标记时,下列标记正确的是________.
A.18O只能标记在醇羟基上
B.18O只能标记在羧酸的羟基上
C.18O可以标记在醇羟基上,也可以标记在羧酸的羟基上
D.18O可以标记在醇羟基上,也可以标记在羧酸的羟基上,还可以标记在羧酸的羰基上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com