
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测.请填写以下实验报告.
某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测.请填写以下实验报告.查看答案和解析>>
科目: 来源: 题型:解答题
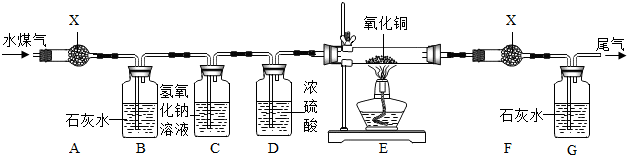
查看答案和解析>>
科目: 来源: 题型:选择题
| 成语或诗词 | 用化学知识解释 | |
| A | 李白诗句“风吹柳花满店香” | 分子不断运动的结果 |
| B | 谚语“烈火见真金” | 金性质稳定,在高温下也不发生化学反应 |
| C | 于谦诗句“粉身碎骨浑不怕” | 石灰石被磨成粉末状的物理变化 |
| D | 成语“百炼成钢” | 经反复锤炼,降低生铁的含碳量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20.7% | B. | 22% | C. | 24.9% | D. | 28% |
查看答案和解析>>
科目: 来源: 题型:解答题
 铁暴露在空气中会生锈.切开的苹果放置不久,果肉上也会产生一层咖啡色的物质,也好象是生了“锈”一样.某化学活动组对此进行了探究.
铁暴露在空气中会生锈.切开的苹果放置不久,果肉上也会产生一层咖啡色的物质,也好象是生了“锈”一样.某化学活动组对此进行了探究.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
 如图是A、B、C三种物质的溶解度曲线,看图回答下列问题:
如图是A、B、C三种物质的溶解度曲线,看图回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
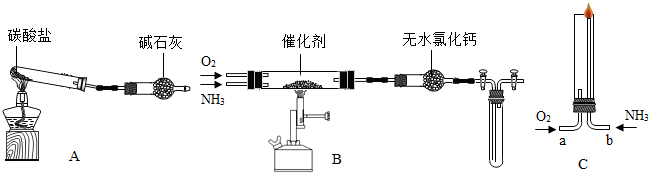
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com