
科目: 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
某温度下,关于①0.01mol·L-1醋酸溶液,②pH=2醋酸溶液,下列说法正确的是( )
A.c(CH3COOH):①>②
B.c(CH3COO-):①>②
C.c(CH3COOH)+c(CH3COO-):①=②
D.c(CH3COO-)+c(OH-):①<②
查看答案和解析>>
科目: 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.pH=1的H2SO4溶液,含H+的数目为2NA
B.1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
C.273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA
D.0.2mol C2H6O分子中一定存在0.2NA个碳碳单键
查看答案和解析>>
科目: 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
将乙醇滴入热的浓硫酸中,发生反应:C2H5OH +6H2SO4 = 6SO2↑+2CO2↑+9H2O,浓硫酸没有体现的性质是( )
A.氧化性 B.脱水性 C.酸性 D.吸水性
查看答案和解析>>
科目: 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
向含b mol Na2CO3的溶液中缓慢滴加含a mol HCl溶液,并不断振荡,下列说法不正确的是( )
A.当a/b>2时,发生的离子反应为:CO32-+H+ = HCO3-,HCO3-+H+ = CO2+H2O
B.当0<a/b<1时,发生的离子反应为:CO32-+H+ = HCO3-
C.当2a=3b时,发生的离子反应为:2CO32-+3H+ = HCO3-+CO2+H2O
D.当1<a/b<2时,溶液中n(HCO3-)为(2a-b)mol
查看答案和解析>>
科目: 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
某混合物X由Na2O、Fe2O3、Cu、SiO2中的一种或几种物质组成。某兴趣小组以两条途径分别对X进行如下实验探究。


下列有关说法不正确的是( )
A.无法判断混合物中是否含有Na2O
B.由Ⅱ可知X中一定存在SiO2
C.1.92g固体成分为Cu
D.15.6g混合物X中m(Fe2O3):m(Cu)=1:1
查看答案和解析>>
科目: 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:填空题
CO和苯都是重要的化工原料。下图是某有机物B合成的过程。

请回答:
(1)反应①的反应类型是 ,反应②所加试剂是 。
(2)关于物质A(CH2 CHCOOH)化学性质的说法正确的是 。
A.物质A含有一种官能团
B.物质A与Na2CO3溶液反应能产生气泡
C.物质A不能使酸性KMnO4溶液褪色
D.常温常压时,物质A呈气态
(3)④的反应机理与制取乙酸乙酯相似,写出其化学方程式: 。
查看答案和解析>>
科目: 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:推断题
已知A与D均为非金属单质,其中A有多种同素异形体,其转化关系如下图。
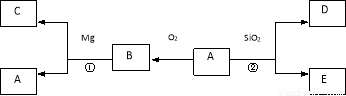
请回答:
(1)反应②为工业制粗硅原理,写出E的化学式: 。
(2)反应①的化学方程式为 。
查看答案和解析>>
科目: 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:实验题
如图装置进行SO2气体性质实验。
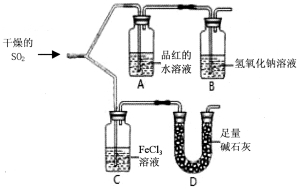
请回答:
(1)仪器D的名称是 。
(2)实验过程中,仪器A中的实验现象是 。
(3)写出仪器C中发生氧化还原反应的离子方程式: 。
查看答案和解析>>
科目: 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:计算题
烧杯中盛有NaHSO4和Na2SO4混合溶液体积为100mL,向烧杯中逐滴加入0.15mol·L-1 Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为200mL。溶液中产生沉淀的物质的量n与溶液的pH变化如图所示。

请回答:
(1)原溶液中c(NaHSO4)= mol·L-1。
(2)图中a值为 mol。
查看答案和解析>>
科目: 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:填空题
碳、硫和氮元素及其化合物的处理,是资源利用和环境保护的重要研究课题。
(1)CO可转化成二甲醚,原理为:2CO(g)+4H2(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线

若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”);
(2)SO2的水溶液呈酸性,某温度下,0.02mol·L-1亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离常数Ka1= 。
(3)已知:反应1:2SO2(g)+O2(g)  2SO3(g) ΔH1;
2SO3(g) ΔH1;
反应2:2NO(g)+O2(g)  2NO2(g) ΔH2;
2NO2(g) ΔH2;
若ΔH1<ΔH2<0,则反应3:SO2(g)+NO2(g)  SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
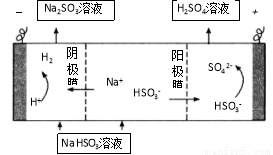
(4)若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图(见右图)。电解时阳极的电极反应式为 。
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g)+NO2(g)  SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。
SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com