
科目: 来源: 题型:
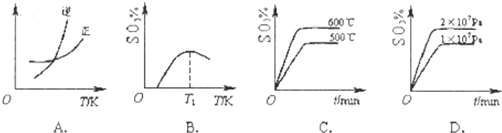
| 1 |
| 2 |
2- 4 |
查看答案和解析>>
科目: 来源: 题型:
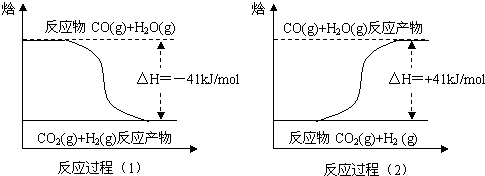
查看答案和解析>>
科目: 来源: 题型:
| A、任何化学反应都伴随着能量的变化 | B、1mol H2S04和1 mol Ba(OH)2完全反应所放出的热量称为中和热 | C、在101kPa时,1 mol碳燃烧放出的热量就是碳的燃烧热 | D、在化学反应中需要加热的反应就是吸热反应 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 温度/℃、00w | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 原料转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目: 来源: 题型:
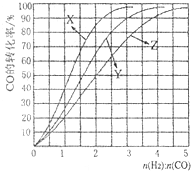 工业上常利用CO和H2合成可再生能源甲醇.
工业上常利用CO和H2合成可再生能源甲醇.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 (1)已知25℃、101kPa时,一些物质的燃烧热为:
(1)已知25℃、101kPa时,一些物质的燃烧热为:| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| △H/( kJ?mol-1) | -283.0 | -285.8 | -726.5 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com