

科目: 来源: 题型:
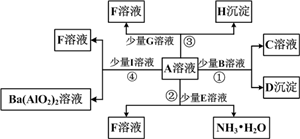
查看答案和解析>>
科目: 来源: 题型:
| c(H2CO3) | ||
c(C
|
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
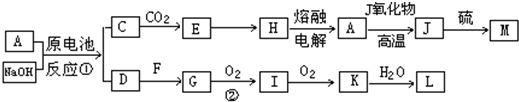
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
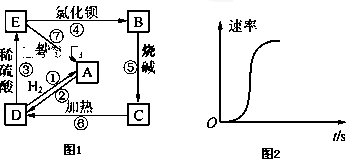 物质A~E都是中学化学中常见的物质,它们可以发生如图1所示的反应,其中E是蓝色溶液.
物质A~E都是中学化学中常见的物质,它们可以发生如图1所示的反应,其中E是蓝色溶液.查看答案和解析>>
科目: 来源: 题型:

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.9 | 11.1 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 3 |
| 2 |
| 3 |
| 2 |
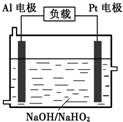
查看答案和解析>>
科目: 来源: 题型:
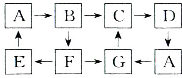
| 物质 | A单质 | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色 | 黄色 | 红褐色 | 红棕色 | 浅绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com