
科目: 来源: 题型:
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸转化变成Zn2+、NH4+●提出假设: (1)假设①:该混合金属粉末中除镁外还含有 假设②:该混合金属粉末中除镁外还含有 假设③:该混合金属粉末中除镁外还含有铝、锌. ●实验探究: 甲同学基于假设③设计实验方案: 操作Ⅰ是在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加足量的稀氨水,请回答:  乙同学基于假设③设计另一方案:  (2)沉淀A、B、D的化学式:A (3)甲同学用样品和稀硫酸反应所得溶液含有较多H+、Mg2+、Al3+、SO42-,向其中滴入NaOH溶液,生成沉淀的量与加入NaOH溶液体积关系可能正确的是  (4)乙同学方案的操作②中,铝与NaOH溶液反应的化学方程式为 操作②与操作③中都加了NaOH溶液,但其用量差别是 (5)丙同学通过分析对比,认为乙的方案比甲同学的好,其理由可能是 查看答案和解析>> 科目: 来源: 题型: [化学--选修2:化学与技术] 工业上通常采用碱法从铝土矿制取Al2O3,如图为碱法制取Al2O3的工艺流程.已知铝土矿中含有的杂质主要是氧化铁、含硅化合物. 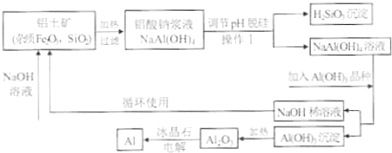 回答下列问题: (1)操作I的名称是 (2)工业上将Al2O3投入熔融的冰晶石,通过电解制备金属铝,冰晶石的作用是 (3)工业上用NaOH溶液溶解铝上矿,是利用了Al2O3的 (4)写出铝土矿中杂质与加入的氢氧化钠溶液反应的离子方程式 (5)往铝酸钠[NaAl(OH)4]溶液中加入晶种Al(OH)3,通过结晶析出氢氧化铝,写出析出氢氧化铝的离子方程式 (6)氢氧化铝在不同温度下分解产物不同,已知: 2Al(OH)3
现有一定温度下加热氢氧化铝得到的固体产物,经测定其中氢元素含量为1.0%,判断固体产物的成分是 查看答案和解析>> 科目: 来源: 题型: 2012年1月,广西河池龙江河段检测出重金属镉离子(Cd2+)含量超标,当地政府积极展开治污工作.聚合氯化铝可以将离子状态的镉固化,这是当前可采取治理镉污染的最有效方法. 已知:①煤矸石是煤矿在洗煤和选煤过程中大量排出的固体废弃物,煤矸石主要含Al2O3、SiO2及铁的氧化物. ②聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂. 以煤矸石为原料,采用铝盐水解絮凝法,制得聚合氯化铝的工艺流程如图1: 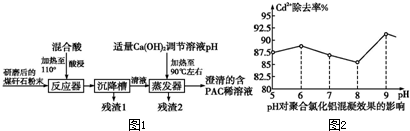 回答下列相关问题: (1)向反应器中加入混合液(20%的硫酸和盐酸)酸浸,其目的是 (2)流程中残渣1可用于工业上制取粗硅,写出该反应的化学方程式 (3)流程中残渣2的主要成分是 (4)聚合氯化铝除镉的原理是生成了氢氧化铝胶体吸附镉离子,确定已生成氢氧化铝胶体的方法可利用胶体性质中的 (5)常温下以溶液pH为横坐标,Cd2+的除去率为纵坐标,实验结果如图所示,由图2可知,Cd2+的除去率最高时,溶液的c(OH-)= 查看答案和解析>> 科目: 来源: 题型: 铝是地壳中含量最高的金属元素,其单质及化合物在生产生活中的应用日趋广泛. (1)在19世纪时,铝是一种珍贵的金属.人们最初得到的铝粒如同珍宝,它的价格同黄金相当.1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝.用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是 (2)冶炼金属铝,第一步先出氧化铝制备无水氯化铝.已知:  2Al(s)+3Cl2(g)═2AlCl3(s)△H=-1390.8kJ/mol 4Al(s)+3O2(g)═2Al2O3(s)△H=-3339.6kJ/mol 2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol AlCl3(s)═AlCl3(g)△H=+akJ/mol(a>0) 则Al2O3(s)+3Cl2(g)+3C(s)═2AlCl3(g)+3CO(g)的△H= (3)LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,写出该反应的化学方程式 (4)铝电池性能优越,铝--空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.该电池的总反应化学方程式为 查看答案和解析>> 科目: 来源: 题型:阅读理解 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等. ①基态Fe3+的M层电子排布式为 ②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 ③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= (2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图1,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 (3)下列说法正确的是 A.第一电离能大小:S>P>Si B.电负性顺序:C<N<O<F C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低 D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 (4)图2是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体. ①图中d单质的晶体堆积方式类型是 ②单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含 ③图3是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 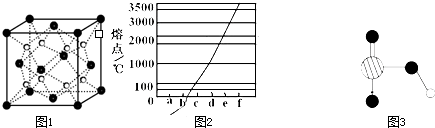 查看答案和解析>> 科目: 来源: 题型:  [化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金. [化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.(1)写出Fe2+的核外电子排布式 (2)[cr(H2O)4Cl2]Cl?2H2O中cr的配位数为 (3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,推测Ni(CO)n的晶体类型 (4)常温下,碳与氢以原子个数比1:1形成的气态氢化物中,其分子中的σ键和П键的数目比是 (5)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如右图所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为 查看答案和解析>> 科目: 来源: 题型: 在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是 查看答案和解析>> 科目: 来源: 题型: 某混和物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化: 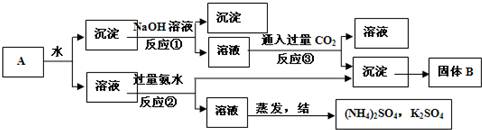 据此判断: (1)固体B的所含物质的化学式 (2)反应①的离子方程式 (3)反应②的离子方程式 (4)反应③的离子方程式 查看答案和解析>> 科目: 来源: 题型: (1)某无色透明的溶液,跟金属铝反应时放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-,在下列两种情况下,可能存在于此溶液中的是: ①当与铝反应后生成Al3+时,原溶液可能存在的离子 ②当与铝反应后生成AlO2-时,原溶液可能存在的离子是 (2)拉曼?光谱表明溶液中不存在AlO2-离子,实际存在[Al(OH)4]-离子,在200mL 0.2mol/L Na[Al(OH)4]溶液中逐滴加入 0.2mol/L H2SO4溶液250mL,试回答: ①写出分两步反应的离子方程式: ②反应完全后,溶液中Al3+离子与SO42-离子的物质的量之比为 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |