
科目: 来源: 题型:阅读理解
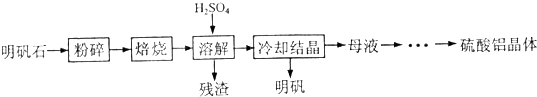
| 物质 | α-Al2O3 | γ-Al2O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α-Al2O3 |
| 温度/℃ 溶解度/g |
0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
查看答案和解析>>
科目: 来源: 题型:
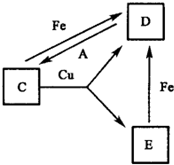 有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:
有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:查看答案和解析>>
科目: 来源: 题型:
| A、Cu2+和Ag+相似,能与NH3结合生成铜氨络离子 | B、白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应 | C、白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下发生了自身氧化还原反应 | D、反应过程中消耗的SO2与生成的SO2的物质的量相等 |
查看答案和解析>>
科目: 来源: 题型:
| A、化学工业中的“三酸”“两碱”是指硫酸、硝酸、盐酸、氢氧化钠、碳酸钠 | B、医疗上的血液透析利用了胶体的性质 | C、正常的雨水pH为7.0,酸雨的pH小于7.0 | D、pH=5的盐酸,稀释1000倍后,溶液pH约为7 |
查看答案和解析>>
科目: 来源: 题型:
| A、Na、Ba、Mg、Al | B、Na、K、Zn、Fe | C、Zn、Fe、Cu、Ag | D、Mg、Al、Zn、Fe |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
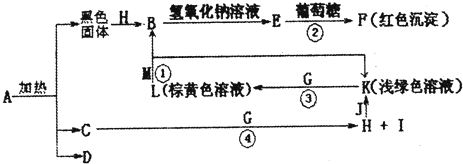
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com