
科目: 来源: 题型:
已知:
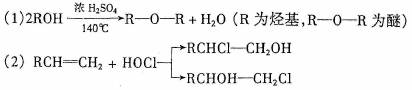
石油裂解得到C2H4可以合成很多物质,如下图:
回答下列问题:
(1)写出F结构简式 。
(2)上述反应中属于取代反应的是 (填反应序号)。
(3)写出B![]() C的化学方程式 。
C的化学方程式 。
(4)反应③中将B与NaOH的乙醇溶液共热,为检验生成产物C(已知:C的沸点小于40℃),某同学认为:将生成气体通入高锰酸钾酸性溶液中,若高锰酸钾溶液褪色,可证明有C生成。该同学的想法是否正确?若不正确,说明理由。
答 _____________________________ 。
(5)X与A互为同分异构体,X的核磁共振氢谱如下图(两个峰面积比为2:3)

物质X的结构简式是: 。
查看答案和解析>>
科目: 来源: 题型:
2-羟基丁二酸存在于苹果中的一种有机物,它结构简式是:
 。
。
(1)2-羟基丁二酸中含有的官能团名称是 ;在一定条件下它可发生化学反应的类型有 (填序号);
A.水解反应 B.取代反应 C.加成反应 D.消去反应 E.加聚反应 F.中和反应
(2)下列物质与2-羟基丁二酸互为同分异构体的是 (填序号);

(3)写出2-羟基丁二酸与乙醇在一定条件下发生反应的化学方程式: ;
(4)2-羟基丁二酸在一定条件下可制得有机物X,X可使溴的四氯化碳溶液褪色。写出X的结构简式 ________ 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol
0~4min时,容器气体压强为101KPa。反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表:
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
回答下列问题:
(1)①______________时,反应处于平衡状态。
②第5min时,从速率和转化率两个方面分析,改变的外界条件是________;平衡向_____方向移动。
③在0.1Mpa、500℃时,起始时O2和SO2的物质的量之比![]() 的值,与SO2平衡时的体积百分含量的变化曲线如图。
的值,与SO2平衡时的体积百分含量的变化曲线如图。

在图中画出在相同压强下,温度为400℃时,起始O2和SO2的物质的量之比![]() 的值,与SO2平衡时的体积百分含量的大致变化曲线。
的值,与SO2平衡时的体积百分含量的大致变化曲线。
(2)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向10mL 0.01mol•L1的H2C2O4溶液滴加0.01mol•L1KOH溶液V(mL),回答下列问题。
①当V<10mL时,反应的离子方程式为 。
②当V=10mL时,溶液中HC2O4、C2O42、H2C2O4、H+的浓度从大到小的顺序为
。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42)+c(HC2O4);
当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42)+c(HC2O4)+c(H2C2O4);则a b(填“<”,“=”或“>”)。
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+) / n(C2O42-)的值将 (填“变大”,“变小”,“不变”),原因是 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
富马酸亚铁FeH2C4O4,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物。某校研究性学习小组通过查阅大量资料后,决定自行制备富血铁并检测其含铁量。
富马酸(HOOC-CH=CH-COOH)的性质:
| 分子式 | 相对分子质量 | 溶解度和溶解性 | 酸性 |
| H4C4O4 | 116 | 在水中:0.7g(25℃)、9.8g (97.5℃)。 盐酸中:可溶。 | 二元酸,且0.1mol/LH4C4O4的pH=2。 |
Fe2+的性质:
| 开始沉淀时的pH | 完全沉淀时的pH |
| 7.6 | 9.6 |
I、富马酸亚铁的制备
①将适量的富马酸置于100ml烧杯中,加水20ml在热沸搅拌下,加入Na2CO3溶液10ml,使其pH为6.5~6.7;
②将上述溶液转移至100ml圆底烧瓶中,装好回流装置,加热至沸;
③缓慢加入新制的FeSO4溶液30ml,维持温度100℃,充分搅拌1.5小时。
④冷却、过滤,洗涤沉淀,然后水浴干燥,得到棕色粉末。
试回答:
步骤①中加入Na2CO3 ,反应的离子方程式_____________(富马酸及其酸根用化学式表示)。
步骤①中反应后控制溶液pH为6.5~6.7;若反应后溶液的pH太小,则引起的后果是_____________。若反应后溶液的pH太大则引起的后果是__________________。
II 产品纯度测定
准确称取富血铁0.3200g,加煮沸过的3mol/LH2SO4溶液15ml,待样品完全溶解后,加煮沸过的冷水50ml和4滴邻二氮菲-亚铁指示剂,立即用(NH4)2Ce(SO4)3(硫酸高铈铵)0.1000mol/L标准溶液进行滴定。直至溶液刚好变为浅蓝色即为终点。测得其体积为18.50mL,计算样品中富血铁的质量分数,写出计算过程。(Fe2+ +Ce4+=Fe3+ + Ce3+)
查看答案和解析>>
科目: 来源: 题型:
有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大。B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐。甲、乙、丙、丁四种物质之间的相互反应关系如下图:
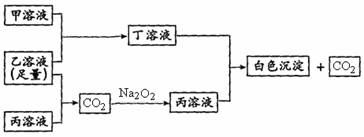
请回答:(1)写出A的最高价的氧化物的电子式____________。
(2)用有关化学用语解释:丙溶液呈碱性的原因________________________________。
(3)写出有关反应的离子方程式:
①甲溶液+乙溶液:______________;②丁溶液+丙溶液:_____________________。
查看答案和解析>>
科目: 来源: 题型:
工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO?Cr2O3、还含有Al2O3、SiO2)。某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7)。实验流程为:
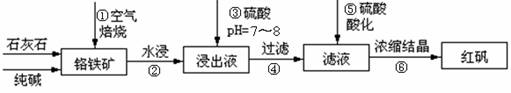
已知焙烧时Al2O3、SiO2发生反应:
SiO2+CaCO3![]() CaSiO3+CO2↑ Al2O3+Na2CO3
CaSiO3+CO2↑ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
焙烧时铬铁矿发生反应:
4FeO?Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①应将反应物装在_______(填仪器名称)中焙烧;步骤④需要用到的玻璃仪器____。
(2)步骤③用硫酸将溶液的pH调至7~8,目的是 ;
并写出有关的离子方程式 。
(3)滤液加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为 。
(4)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。②③④的实验操作方法分别是_______________。
| 序号 | 实验操作方法 | 实验操作过程 |
| ① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌 |
| ② | 将所得溶液沿玻璃棒引流至蒸发皿中,边加热边用玻璃棒搅拌溶液,使NaC1结晶析出 | |
| ③ | 趁热将NaC1晶体与溶液分离 | |
| ④ | 冷却滤液使K2Cr2O7析出 | |
| ⑤ | 过滤 | 得到K2Cr2O7晶体 |
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组将15mL氯气慢慢溶于1000mL自来水,发现溶于自来水后的溶液黄绿色很浅,接近无色。为探究氯气溶于自来水中是否可与水反应,某同学做出如下假设:
①氯气溶于自来水,不与水反应; ②氯气溶于自来水,可与水反应。
(1)甲同学(甲、乙为小组成员)设想用测定pH的方法探究以上假设。请你利用甲同学刚制得的液体,帮助甲同学设计实验方案。实验中可选用下列仪器、用品和药品:玻璃片、玻璃棒、pH试纸(含比色卡),石蕊试液、酚酞、蒸馏水、自来水、烧杯、胶头滴管、pH计(使用时将待测液加入烧杯中,把pH计插入待测液中,待读数稳定后,直接读取溶液的pH值)。
写出实验步骤(不必填满,也可根据你的设计添加步骤④…),
①__________________________________________________________________。
②__________________________________________________________________。
③__________________________________________________________________。
(2)乙同学设想选用AgNO3溶液探究上述问题,该设想是否正确,并解释原因。答:
__________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
在实验室里可用下图所示装置制取KClO3、NaClO。
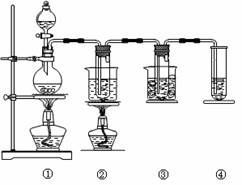
②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;发生反应生成KClO3。
③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________(填写化学试剂名称)的净化装置;④中装的试剂是________________。
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:________________________。③的试管中反应的离子方程式为________________________________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
削过皮的苹果过一段时间后颜色就会由白色变为褐色,食品科学上称为“褐变”。某研究性学习小组查阅有关资料,发现不同文献解释不同。
I、《化学教学》:苹果中Fe2+被空气中的O2氧化成Fe3+而变色。
II、《中学化学教学参考》:苹果中的酚类物质在苹果中的氧化酶催化下被空气中的O2氧化而生成有色物质。
已知酚类物质遇FeCl3溶液常发生颜色反应而呈现一定颜色。如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色。
(1) 为探究苹果“褐变”是否为I的原因,小组设计了如下实验:①刚削皮的苹果立刻滴上2~3滴A溶液,继而再滴上几滴氯水。②在“褐变”后的苹果滴上2~3滴A溶液。
回答下列问题:
A溶液是________溶液(填化学式)。若I的解释正确,写出①中有关的离子方程式:
___________________________________________________________________________;
实验①②的实验现象应为:①_________________________。
②__________________________。
经实验,①②均无明显现象。说明观点I的解释是错误的。
(2)为探究苹果“褐变”是否为II的原因,小组又设计了如下实验。在表中填写实验①②探究目的和结论。
| 序号 | 实验步骤 | 现象 | 探究目的和结论 |
| ① | 将刚削皮的苹果立刻放入隔绝空气的环境中 | 相当长一段时间内,无明显变化 | |
| ② | 将刚削皮的苹果立刻放入90℃~95℃的水中2min,再放在空气中。 再将另一块刚削皮的苹果立刻放入稀盐酸中浸泡2min后取出洗净,再放在空气中。将盐酸改为酒精、醋酸铅溶液进行相同实验。 | 相当长一段时间内,均无明显变化 | |
| ③ | 在刚削皮的苹果上滴加FeCl3溶液。 | 苹果由白色变为绿色 | 探究目的:探究苹果中是否含有酚类物质。结论:苹果中含有酚类物质。 |
查看答案和解析>>
科目: 来源: 题型:
针剂氯霉素因含羟基而具有苦味,把氯霉素分子中碳链末端羟基(-OH)中的氢原子被棕榈酸中的原子团![]() 取代后,苦味消失,成为便于口服的无味氯霉素。以下叙述中不正确的是( )
取代后,苦味消失,成为便于口服的无味氯霉素。以下叙述中不正确的是( )
A.上述转化的反应是酯化反应
B.口服无味氯霉素是棕榈酸的酯类
C.口服无味氯霉素苦味消失,与它溶解性有关
D.针剂氯霉素和口服氯霉素化学成份不同,故治病故机理完全不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com