
科目: 来源: 题型:
下列行为中不利于保护地球环境的是( )
A.研发可降解塑料,控制白色污染
B.植树造林,控制工业废水的排放
C.加强新能源研究,使用压缩天然气、氢气作汽车燃料
D.大量开采煤、石油以满足工业发展的需要
查看答案和解析>>
科目: 来源: 题型:
苯的同系物与卤素单质混合,在光照条件下,侧链上的氢原子被取代;在催化剂存在的条件下,苯环上的氢原子被取代。又已知:

α―溴代肉桂酸是一种抗菌、抗病毒的高效除臭剂,合成它的路线如下:
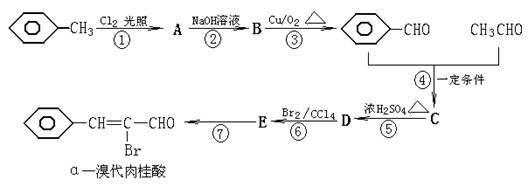
⑴、写出反应类型:⑤________________________,⑥________________________
⑵、写出②的化学方程式______________________________________________________。
⑶、C有多种同分异构体,请写出符合下列条件的同分异构体的结构简式
①苯环上只有一个侧链 ②属于酯类物质 ③能发生银镜反应它们分别为
_______________、___________________ 。
⑷、B经催化氧化还可得到另一种有机物F,F可与B反应生成具有果香味的G物质,写出生成G的化学方程式_____________
查看答案和解析>>
科目: 来源: 题型:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有![]() Ti和
Ti和![]() Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素。
Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素。
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是 。
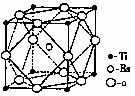
(3)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2?H2O。配离子[TiCl(H2O)5]2+中含有的化学键类型是 ,该配合物的配体是 。
查看答案和解析>>
科目: 来源: 题型:
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
【探究一】实验方案:铝镁合金![]() 测定剩余固体质量
测定剩余固体质量
实验中发生反应的化学方程式是
实验步骤:
(1)称取5.4g 铝镁合金粉末样品,投入VmL 2.0 mol?L-1 NaOH溶液中,充分反应。NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”或“偏低”)。
[探究二]
实验方案:铝镁合金![]() 测定生成气体的体积实验装置:
测定生成气体的体积实验装置:

问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是: (填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
① ②
[探究三]
实验方案:称量x g铝镁合金粉末.放在如下图所示装置的惰性电热板上,通电使其充分灼烧。

问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是
(2)若用空气代替O2进行实验,对测定结果是否有影响? (填“是”或“否”)。
[实验拓展]
参照探究一、探究二实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族。A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2―离子含10个电子。
(1)工业制取D单质的反应方程式是 。
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应。甲的一种用途是 。由甲中的两种元素组成,且与甲等电子的物质乙的分子式是 ,乙、水化合的产物与C的单质在KOH溶液中形成燃料电池的正极反应式为 。
(3)D的单质在C的单质中燃烧,生成物中含有的化学键为 、 。 将该物质投入水中发生反应的离子方程式 :
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应化学方程式是
。
(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是: ,戊在工业上常做为绿色氧化剂的优点是: 。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ 在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%, 体积变为10 L。求:
①该条件下的平衡常数 。
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。试比较反应放出的能量: ① ②(填“>”、“<”或“=”)
Ⅱ 若将2mol N2和4mol H2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡。
③试比较平衡时NH3的浓度:Ⅰ Ⅱ(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ。
①请写出该反应的热化学方程式 。
②Marnellos和Stoukides发明了电化学制备氨气方法,该方法用SCY陶瓷将阳极和阴极隔开,SCY陶瓷具有高质子导电性,其作用是传递H+,这种方法实现了高温常压下高转化率的电化学合成氨。已知阴极的电极反应为N2+6e-+6H+=2NH3,则阳极发生的电极反应为: 。
查看答案和解析>>
科目: 来源: 题型:
常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆过程
②氨水中水电离出的c(OH―) 10-7mol/L(填写“>”、“<”或“=”)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为 。
查看答案和解析>>
科目: 来源: 题型:
在一定体积pH=1的HCl与HNO3的混合溶液中,逐滴加入c mol?L-1的AgNO3溶液,当溶液中的Cl- 恰好完全沉淀时,溶液pH=2。若反应后溶液的体积等于反应前两溶液体积之和,则原溶液中NO3-的物质的量浓度是( )
A.0.1c mol?L-1 B.9c mol?L-1 C.(0.1-9c) mol?L-1 D.(0.9-c)mol?L-1
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.某二元弱酸的酸式盐NaHA溶液中:c(H+)十c(Na+)= c(OH-)+c(HA-)+c(A2-)
B.一定量的(NH4)2SO4与NH3?H2O混合所得的碱性溶液中:c(NH![]() )>2c(SO
)>2c(SO![]() )
)
C.在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的混合溶液中:
c(CH3COOH)+c(CH3COO-)= 0.01mol/L
D.相同温度下物质的量浓度相等的NH4HSO4溶液、NH4HCO3溶液、NH4Cl溶液中
c(NH![]() ):c(NH4HSO4)> c(NH4HCO3)> c(NH4Cl)
):c(NH4HSO4)> c(NH4HCO3)> c(NH4Cl)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com