
科目: 来源: 题型:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
化学键 | Si―O | Si―Cl | H―H | H―Cl | Si―Si | Si―C |
键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC__________Si; SiCl4___________SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?____________(填“能”或“不能”),原因是_________________________________________________________
(3)如图立方体中心的“? ”表示金刚石晶体中的一个原子,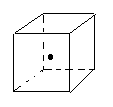 请在立方体的顶点用“? ”表示出与之紧邻的碳原子
请在立方体的顶点用“? ”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s)+4HCl(g)
计算该反应的反应热△H为__________________________
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式_________,F元素原子的电子排布式_________________,
E元素的原子结构示意图是__________________
(2)化合物乙中含有的化学键是____________________________
(3)化合物甲为固体时属于________晶体,E单质在一定条件下与甲反应的化学方程式
为____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),
回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是___________
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是____________
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____________
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是_______区元素,其氯化物的化学式为___________________
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明了原子核外________________________________________________,如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第_____个。
(6)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________________________, 其中元素_______的第一电离能反常高的原因是___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)
正四面体分子_______,三角锥形分子________,V形分子_________。
查看答案和解析>>
科目: 来源: 题型:
根据VSEPR模型,H3O+的分子立体结构为:___________ ________________,
BCl3的立体结构为:___________ _________________。
查看答案和解析>>
科目: 来源: 题型:
在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是________ _______,画出配合物离子 [Cu(NH3)4]2+中的配位键__________ __________ 。
查看答案和解析>>
科目: 来源: 题型:
在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和主族数(A)有如下经验公式:K=A/n (K为A与n的比值)。请选编号回答下列问题:
A.两性 B.金属 C.非金属 D.稀有气体
(1)当n一定时,K值越大,则元素的_____________性越强。
(2)当A一定时,K值越小,则元素的________性越强。
(3)当K=0,则该元素系_________元素,当K=l时,则该元素系_________元素,
当K<1时,则该元素系_________元素。
查看答案和解析>>
科目: 来源: 题型:
下列数据是对应物质的熔点,有关的判断错误的是
Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物分子中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
查看答案和解析>>
科目: 来源: 题型:
下列关于主族元素的说法正确的是
A.主族元素的原子核外电子最后填入的能级是s能级
B.主族元素的原子核外电子最后填入的能级是s能级或p能级
C.主族元素的最高正价等于主族的序数
D.主族元素的价电子数有可能超过最外层电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com