
科目: 来源: 题型:
下图为可逆反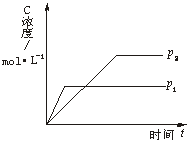 应A(g)+2B(g)
应A(g)+2B(g)![]() nC(g)(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是
nC(g)(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是
A. p2>p1,n<3
B. p2>p1,n>3
C. p1>p2,n<3 ![]()
D. p1>p2,n>3
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,把2. 0体积的N2和6. 0![]() 体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2
体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2![]() 2NH3。已知平衡时NH3的浓度是c mol?L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol?L-1的是
2NH3。已知平衡时NH3的浓度是c mol?L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol?L-1的是
A. 1.0体积的N2和3.0体积的H2
B. 2.0体积的N2、6.0体积的H2和4.0体积的NH3![]()
C. 4.0体积的NH3和1.0体积的H2![]()
D. 2.0体积的NH3
查看答案和解析>>
科目: 来源: 题型:
反应2A(g) ![]() 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A. 加压 B. 减压 C. 减少E的浓度 D. 降温
查看答案和解析>>
科目: 来源: 题型:
在一密闭容器内发生氨分解反应:2NH3![]() N2+3H2。已知NH3起始浓度是2.6 mol?L-1,4s末为1.0 mol?L-1,若用NH3的浓度变化来表示此反应的速率,则v(NH3)应为
N2+3H2。已知NH3起始浓度是2.6 mol?L-1,4s末为1.0 mol?L-1,若用NH3的浓度变化来表示此反应的速率,则v(NH3)应为
A. 0.04 mol?L-1?s-1 B. 0.4 mol?L-1 ?s-1
C. 1.6 mol?L-1?s-1 D. 0.8 mol?L-1?s-1
查看答案和解析>>
科目: 来源: 题型:
将4 mol A气体和 2 mol B 气体在2 L容器中混合,并在一定条件下发生如下反应:
2A(g)+B(g)![]() 2C(g)若经2 s后测得C的浓度为0.6 mol?L-1,现有下列几种说法,其中正确的是
2C(g)若经2 s后测得C的浓度为0.6 mol?L-1,现有下列几种说法,其中正确的是 ![]()
①用物质A表示的反应的平均速率为0.3 mol?L-1?S-1
②用物质B表示的反应的平均速率为0.6 mol?L-1?S-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol?L-1
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目: 来源: 题型:
已知:在298K、100kPa时,
①C(s,石墨)+O2(g) = CO2(g) △H1 = -400 kJ?mol-1;
②2H2(g)+O2(g) = 2H2O(l) △H2 = -570 kJ?mol-1;
③2C2H2(g)+5O2(g) = 4CO2(g)+ 2H2O(l) △H3 = -2600 kJ?mol-1;
(1)写出298K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式 。
(2)现有一定量的乙炔在足量氧气中完全燃烧,放出热量650 kJ。将反应后的二氧化碳气体缓缓通入到含有0.5 mol Ca (OH)2的澄清石灰水中充分反应。
将反应后的物质分为a、b、c三等份,分别进行下列实验,回答相应问题:
①在a中加入少量的氢氧化钠溶液,写出反应的离子方程式 。
②加热b,发生反应的离子方程式 。
③在c中加入适量的FeCl3溶液,观察到的实验现象是 。
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,在一体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:
2X(g)+Y(g) ![]() a Z(g)+W(g) △H=-Q kJ?mol-1(Q>O)(a是正整数)当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g)+W(g) △H=-Q kJ?mol-1(Q>O)(a是正整数)当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值_______________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为______________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?___________________,其理由是____________________________________________________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是_____________(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、O.5 mol W
D.2 molX、1mol Y、lmolZ
(5)X的转化率α=_______________________(用含Q、Q1的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)= CH4(g)+HC≡CH(g)+H2(g);△H1=156.6 kJ?mol-1
CH3CH=CH2(g) =CH4(g)+HC≡CH(g);△H2=32.4 kJ?mol-1
则相同条件下,反应C3H8(g) =CH3CH=CH2(g)+H2(g)的△H=_____kJ?mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为____________________________________________________;放电时,CO32-移向电池的_____ __(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.lmol?L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是________________________________________________________(用离子方程式和必要的文字说明)。
查看答案和解析>>
科目: 来源: 题型:
已知水在25℃和95℃时,
其电离平衡曲线如右图所示: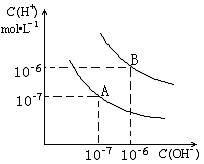
(1)则25 时水的电离平衡曲线应为 (填“A”或“B”),请说明理由
(2)25时,将=9的NaOH溶液与=4的溶液混合,若所得混合溶液的 =7,则NaOH溶液与溶液的体积比为
(3)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的1与强碱的2之间应满足的关系是
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合
后,混合溶液的pH=5。请分析其原因:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com