

科目: 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:选择题
右图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。 下列说法一定正确的是
下列说法一定正确的是
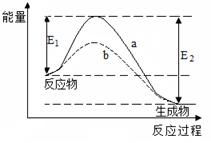
A.该反应为吸热反应
B.反应物吸收的总能量小于生成物释放的总能量
C.a与b相比,反应的平衡常数一定不同
D.a与b相比,a的反应速率更快
查看答案和解析>>
科目: 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:选择题
在一定条件下,向0.1 mol/L的CH3COONa溶液中滴加CH3COOH溶液至混合溶液中离子浓度满足如下关系c(Na+) + c(OH-) = c(H+)+ c(CH3COO-),则下列叙述正确的是
A.混合溶液中:c(OH-) > c(H+)
B.混合溶液中:c(CH3COO-)= 0.1 mol/L
C.混合溶液中:c(Na+) > c(CH3COO-)
D.混合溶液中:c(Na+) = c(CH3COO-)
查看答案和解析>>
科目: 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:选择题
已知:Ksp(RCl)=1.8×10—10,Ksp(RI)=1.5×10—16 ,Ksp(R2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,R+浓度大小顺序正确的是
A.RCl>RI> R2CrO4 B.RCl> R2CrO4>RI
C.R2CrO4>RCl>RI D.R2CrO4>RI>RCl
查看答案和解析>>
科目: 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:选择题
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH + 3O2 = 2 CO2 + 3H2O,电池构造如下图。下列关于该电池的说法不正确的是

A.放电过程中,电源内部的H+从正极区向负极区迁移
B.通入乙醇的电极是负极
C.该电池的正极反应为:4H+ + O2
+ 4 =
2H2O
=
2H2O
D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L
查看答案和解析>>
科目: 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:选择题
已知在298K、101kPa时,
(1)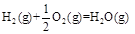
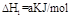 (2)
(2)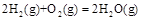
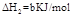
(3)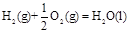
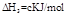 (4)
(4)
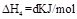
下列关系式中正确的是
A.2a=b<0 B.a<c<0 C.b>d>0 D.2c=d>0
查看答案和解析>>
科目: 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:选择题
某温度下, 反应H2(g)+CO2(g)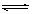 H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数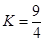 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如下图所示:
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如下图所示:
|
起始量 |
甲 |
乙 |
丙 |
|
H2 (mol) |
1 |
2 |
2 |
|
CO2(mol) |
1 |
1 |
2 |
下列判断不正确的是
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C. 平衡时, 乙中H2的转化率大于60%
D. 平衡时, 丙中c(H2 ) 是0. 08 mol·L-1
查看答案和解析>>
科目: 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:填空题
(9分) 漂白粉是日常生活中的一种常用消毒剂、杀菌剂和漂白剂。请根据要求回答问题:
(1)漂白粉的有效成分是次氯酸钙[Ca(ClO)2],将氯气通入熟石灰(含水的质量分数略小于1%)即可制取,该反应的化学方程式为 ______________________________。
(2)漂白粉具有漂白作用是因为Ca(ClO)2水解生成了次氯酸(HClO),写出该水解反应的离子方程式_______________________________。
(3)Ca(ClO)2溶液中各离子浓度由大到小的顺序是____________________________。
(4)空气中的二氧化碳可以可增强漂白粉的漂白效果,用化学方程式表示其原理__________________________________________。
(5)漂白粉与洁厕剂等强酸性物质混合使用可生成一种有毒气体,写出该反应的离子方程式________________________________________。
查看答案和解析>>
科目: 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:填空题
(6分)某种工业废水中含有一定量的Cr2O72-和CrO42-,它们易被人体吸收积累而导致肝癌。污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
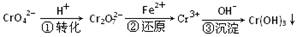
(1)已知第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①Cr2O72-中Cr的化合价是 。
②若平衡体系的pH=10,则溶液显 色。
(2)第②步发生反应的离子方程式为 _______ ,还原1mol Cr2O72—离子,需要_______mol的FeSO4·7H2O;
(3)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
查看答案和解析>>
科目: 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:填空题
(8分)氯碱工业中电解饱和食盐水的原理示意图如下图所示:
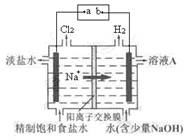
(1)电极a是电源的 。
(2)溶液A的溶质是(填化学式) 。
(3)电解饱和食盐水的离子方程式是 。
(4)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 _______________________________________________________ 。
(5)电解所用的盐水需精制,去除盐水中的Ca2+、Mg2+、NH4+和SO42-,提供的试剂有① Na2CO3溶液 ② BaCl2 溶液③ NaOH溶液 ④ HCl,加入试剂的顺序是________________。
查看答案和解析>>
科目: 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:填空题
(10分) 利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,溶液中只存在OH—、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH—)>c(H+),则这两种溶质是 _________ 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)以石墨电极电解100 mL 0.1 mol·L-1CuSO4溶液。若阳极上产生气体的物质的量为0.01 mol,则阴极上析出Cu的质量为 g。
(4)将AgCl分别放入①5mL H2O ②10mL0.2mol·L-1 MgCl2 ③20 mL0.5mol·L-1 NaCl溶液 ④40 mL0.1mol·L-1HCl中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是________________。
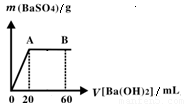
(5)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如右图所示,B点溶液的pH=7(忽略溶液体积变化),则c(HCl)=_________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com