
科目: 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是:( )
A.纸层析法只能用于有色离子的分离,否则无法看到色斑
B.将20g硝酸钠和17g氯化钾放入100ml烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体
C.用如图所示装置测定空气中甲醛含量,若抽气速度过快会导致测定的甲醛含量偏低
D.用移液管取液后,将移液管垂直伸入容器里面,松开食指使溶液全部流出,数秒后取出

查看答案和解析>>
科目: 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:选择题
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法正确的是:( )
A.四种元素的原子半径由小到大的顺序为:r(X)<r(Y)<r(Z)<r(W)
B.X、Y、Z既能形成离子化合物,又能形成共价化合物
C.X与其余三种元素之间形成的核外电子总数为10的微粒只有4种
D.H2Z的熔点比H2W高,是因为它们的晶体类型不同
查看答案和解析>>
科目: 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:选择题
如图是一种可充电的锂离子电池充、放电的工作示意图。放电时该电池的电极反应式为:
负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2)
下列有关说法正确的是:( )
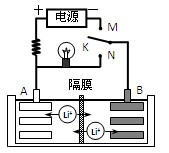
A.该电池的反应式为Li1-xMnO2+LixC6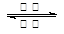 LiMnO2+C6
LiMnO2+C6
B. 在整个充电或放电过程中都只存在一种形式的能量转化
C.K与N相接时,Li+由A极区迁移到B极区
D.K与M相接时,A是阳极,发生氧化反应
查看答案和解析>>
科目: 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是:( )
A.按系统命名法,有机物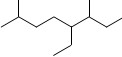 可命名为3,7-二甲基-4-乙基辛烷
可命名为3,7-二甲基-4-乙基辛烷
B.已知Ka是平衡常数,PKa=-lgKa
|
|
羧基(—COOH) |
巯基(—SH) |
H2O |
|
pKa |
3.7 |
9.8 |
16 |
则下图所示有机物1mol最多能消耗3molNaOH
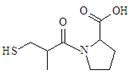
C.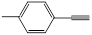 分子中所有原子共平面
分子中所有原子共平面
D.碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种
查看答案和解析>>
科目: 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是:( )
A.反应A(g) 2B(g);△H,若正反应的活化能为Ea kJ
mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
2B(g);△H,若正反应的活化能为Ea kJ
mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
B.已知25℃时,有关弱酸的电离平衡常数:HCN Ka=4.9×10-10 ; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11。则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3
C.已知:
|
共价键 |
C-C |
C=C |
C-H |
H-H |
|
键能/ kJ·mol-1 |
348 |
610 |
413 |
436 |
则反应 的焓变为ΔH
= -384
kJ·mol-1
的焓变为ΔH
= -384
kJ·mol-1
D、一定浓度的NaOH溶液,温度升高PH值不变
查看答案和解析>>
科目: 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:选择题
工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
已知:
(1)步骤①中存在平衡:2Cr O42—(黄色)+2H+ Cr2O42—(橙色)+H2O
Cr2O42—(橙色)+H2O
(2)步骤③生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:[来源:]
Cr(OH)3(s) Cr3+(aq)+3OH 一(aq)
Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1 时可视作该离子不存在下列有关说法中,正确的是:( )
A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大
B.步骤①中当2v(CrO42 一)=v(Cr2O72—)时,说明反应2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O 达到平衡状态
Cr2O72—(橙色)+H2O 达到平衡状态
C.步骤②中,若要还原1 mol Cr2O72一离子,需要12 mol(NH4)2Fe(SO4)2·6H2O。
D.步骤③中,当将溶液的pH 调节至6 时,则可认为废水中的铬已除尽
查看答案和解析>>
科目: 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:填空题
(15分)2011年9月29日21时天宫一号在酒泉卫星发射中心发射成功,标志着中国航天迈入了新的台阶,火箭推进剂是成功发射火箭的重要因素。推进剂主要由可燃剂和氧化剂组成,根据化学物质的形态不同推进剂可分为固体推进剂和液体推进剂,它们一般由C、H、O、N中的一种或几种元素组成。请回答下列问题:
(1)已知某固体推进剂主要由可燃剂(聚丁二烯等)和氧化剂甲(一种由三种元素组成的盐)组成,该盐溶液中加入硝酸银溶液,无明显现象,则甲物质所含的化学键类型 ,并用离子方程式表示甲的水溶液呈酸性的原因 。
(2)已知某液体推进剂主要由可燃剂肼(N2H4)和氧化剂乙组成,乙所含有的电子数和肼分子相同,常温下,乙和肼反应生成一种常见的液态化合物和一种常见的稳定单质,试写出该反应的化学方程式 。列举乙的另一种主要用途 。
(3)根据上述原理,以下物质中可能作为推进剂的是 。
A.石油产品 B.四氯化碳 C.液氟 D.纯碱
(4)戊也可作液体推进剂的氧化剂,取19.6g化合物戊,隔绝空气加热使其完全分解,生成氮气、氧气和二氧化碳,生成的氮气折合成标准状况下的体积为4.48L,生成的二氧化碳气体被足量的澄清石灰水吸收,得到10.0 g沉淀,生成的氧气折合成标准状况下的体积为 L;戊的化学式为 。
(5)请设计一个实验方案,探究由上述四种元素组成的常见无机盐可能的成份。
__________________________________________
查看答案和解析>>
科目: 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:填空题
(15分)纳米级Cu2 O 粉末,由于量子尺寸效应,其具有特殊的光学、电学及光电化学性质,在太阳电池、传感器、超导体、制氢和电致变色、环境中处理有机污染物等方面有着潜在的应用。
Ⅰ.纳米氧化亚铜的制备
(1)四种制取Cu2O的方法如下:
①火法还原。用炭粉在高温条件下还原CuO;
②最新实验研究用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。
已知:N2H4(l)+O2(g) N2(g)+2H2O(l)
△H=-a
kJ/mol
N2(g)+2H2O(l)
△H=-a
kJ/mol
Cu(OH)2(s) CuO(s)+H2O(l) △H=b kJ/mol
CuO(s)+H2O(l) △H=b kJ/mol
4CuO(s) 2Cu2O(s)+O2(g)
△H=c
kJ/mol
2Cu2O(s)+O2(g)
△H=c
kJ/mol
则该方法制备Cu2O的热化学方程式为 。
③工业中主要采用电解法:用铜和钛作电极,电解氯化钠和氢氧化钠的混合溶液,电解总方程式为:2Cu+H2O Cu2O+H2↑,则阳极反应式为:
。
Cu2O+H2↑,则阳极反应式为:
。
④还可采用Na2SO3还原CuSO4法:将Na2SO3 和CuSO4加入溶解槽中,制成一定浓度的溶液,通入蒸气加热,于100℃~104℃间反应即可制得。写出该反应的化学方程式: 。
Ⅱ.纳米氧化亚铜的应用
(2)用制得的Cu2O进行催化分解水的实验
①一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入10. 0 mol水蒸气,发生反应:
2H2O(g)  2H2(g)+O2(g)
△H=+484 kJ·mol-1
2H2(g)+O2(g)
△H=+484 kJ·mol-1
T1温度下不同时段产生O2的量见下表:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
1.0 |
1.6 |
2.0 |
2.0 |
前20 min的反应速率 v(H2O)= ;该该温度下,反应的平衡常数的表达式K= ;若T2温度下K=0.4,T1 T2(填>、<、=)
②右图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;

③用以上四种方法制得的Cu2O在其它条件相同下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。

A.方法③、④制得的Cu2O催化效率相对较高
B.方法④制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有
D.Cu2O催化水分解时,需要适宜的温度
查看答案和解析>>
科目: 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:实验题
(14分)实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
|
化合物 |
相对分子质量 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
|
正丁醇 |
74 |
0.80 |
118.0 |
9 |
|
冰醋酸 |
60 |
1.045 |
118.1 |
互溶 |
|
乙酸正丁酯 |
116 |
0.882 |
126.1 |
0.7 |
请回答有关问题。
Ⅰ.乙酸正丁酯粗产品的制备
在A中加入11.5mL正丁醇和7.2mL冰醋酸,再加3~4滴浓硫酸,混合均匀,投入沸石。如图所示安装分水器、温度计及回流冷凝管,并在分水器中预先加水至略低于支管口,加热回流,反应一段时间将水逐渐分去,至反应完毕。

(1)仪器A中发生反应的化学方程式为____________________________。有同学拟通过某种方法鉴定所得产物中是否含有杂质,可采用 确定。
a.红外光谱法 b.1H核磁共振谱法 c.质谱法
(2)“反应中利用分水器将水分去”该操作的目的是: 。
(3)反应时加热有利于提高酯的产率,但温度过高酯的产率反而降低,其可能的原因是 。
(4)可根据 现象来判断反应完毕。
Ⅱ.乙酸正丁酯粗产品的精制
(5)将仪器A中的液体转入分液漏斗中,用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是 。
(6)再用10ml 10%Na2CO3溶液洗涤有机层,该步操作的目的是 。
(7)将干燥后的产品蒸馏收集乙酸正丁酯产品时,应将温度控制在 左右。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:填空题
(14分) 近年来,我国部分地区相继发现一些以发热伴血小板减少为主要表现的感染性疾病病例。氯吡格雷是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中一种合成路线如下:

|
(1)D的官能团除了氯原子外还有(填名称) 。
(2)有关A、C、D的下列说法正确的是
A.C→D的反应属于取代反应
B.A能与H2发生还原反应,但不能发生氧化反应
C.A、C、D在一定条件下都能与NaOH溶液反应
D.D易溶于水和氯仿
(3)X的结构简式为 。
(4) E与 在酸性条件下生成氯吡格雷和另一种常见有机物,试写出该反应的化学方程式。
在酸性条件下生成氯吡格雷和另一种常见有机物,试写出该反应的化学方程式。
(5)写出A属于芳香族化合物的所有同分异构体的结构简式: 。
(6)已知:
在下列方框内写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选)。合成路线流程示意图为:
的合成路线流程图(无机试剂任选)。合成路线流程示意图为:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com