

科目: 来源:同步题 题型:填空题
查看答案和解析>>
科目: 来源:同步题 题型:填空题
查看答案和解析>>
科目: 来源:同步题 题型:单选题
查看答案和解析>>
科目: 来源:同步题 题型:单选题
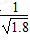 ×10-11mol/L
×10-11mol/L查看答案和解析>>
科目: 来源:江苏高考真题 题型:不定项选择题
| 下列根据实验操作和现象所得出的结论正确的是 | ||||||||||||||||||||
|
[ ] | ||||||||||||||||||||
|
查看答案和解析>>
科目: 来源:江苏高考真题 题型:填空题
查看答案和解析>>
科目: 来源:浙江省高考真题 题型:单选题
 H2O(l) 的ΔH = 40.69 kJ·mol-1
H2O(l) 的ΔH = 40.69 kJ·mol-1 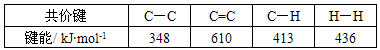 则可以计算出反应
则可以计算出反应 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1 查看答案和解析>>
科目: 来源:江西省模拟题 题型:单选题
 2SO3(g)△H=-197kJ/mol实验测得4molSO2参加上述反应放出354kJ热量,则SO2的转化率最接近于90%
2SO3(g)△H=-197kJ/mol实验测得4molSO2参加上述反应放出354kJ热量,则SO2的转化率最接近于90% 查看答案和解析>>
科目: 来源:山东省期中题 题型:单选题
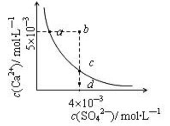
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com