

科目: 来源: 题型:
下列说法正确的是( )
A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键
B.含有共价键的物质一定是共价化合物
C.分子中一定含有化学键
D.含有金属元素的离子一定是阳离子
查看答案和解析>>
科目: 来源: 题型:
在研究物质变化时.人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化。据此判断以下叙述错误的是( )
A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B.物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来
C.氮分子内部存在着很强的共价键,故通常状况下氮气化学性质很活泼
D.需要加热才能发生的反应不一定是吸收能量的反应
查看答案和解析>>
科目: 来源: 题型:
下表数据是在某高温下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化膜的实验记录:
| 反应时间t/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚Y/nm NiO层厚Y’/nm | 0.05a b | 0.20a 26 | 0.45a 3b | 0.80a 4b | 1.25a 5b |
注:a、b 均为与温度有关的常数
请填空回答:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是__________________________________。
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是_________________(填直线、抛物线、对数或双曲线等类型);MgO氧化膜膜厚Y属_________型,NiO氧化膜膜厚Y’属_______型。
(3)Mg与Ni比较,哪种金属具有更良好的耐氧化腐蚀性?_________________,
其理由是:________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
某化学反应2A ![]() B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
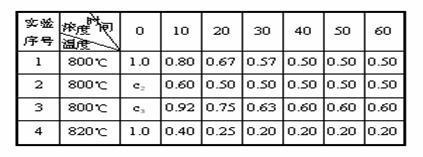
根据上述数据,完成下列填空:
⑴在实验1,反应在10至20min时间内平均速率为 mol?(L?min)-1。
⑵在实验2,A的初始浓度c2= mol?L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
⑶设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1(填“>”“=”“<”),且c3 1.0mol?L-1(填“>”“=”“<”)。
⑷比较实验4和实验1,可推测该反应是 反应(选填“吸热”“放热”)。理由是 。
查看答案和解析>>
科目: 来源: 题型:
把0.6 mol X 气体和0.4 mol Y气体混合于2 L容器中,使它们发生如下反应:
3X(g)+Y(g)![]() nZ(g)+2W(g)
nZ(g)+2W(g)
5min末已生成0.2 molW,若测知以Z浓度变化来表示的反应平均速率为0.01 mol?(L?min)-1,则
(1)上述反应中Z气体的计量系数n的值是
A.1 B.2 C.3 D.4
(2)上述反应在5 min 末时,已反应掉的Y值占原来的百分比是
A.20% B.25% C.33% D.50%
查看答案和解析>>
科目: 来源: 题型:
反应速率v和反应物浓度的关系是用实验方法测定的。化学反应:
H2(g)+Cl2(g)=2HCl(g)
的反应速率v可表示为:v=k{c(H2)}m×{c(Cl2)}n
式中,k为常数,m、n值可用下表中数据确定之。
 由此可推得,m、n值正确的是
由此可推得,m、n值正确的是
A.m=1,n=1
B.m=![]() ,n=
,n=![]()
C.m=![]() ,n=1
,n=1
D.m=1,n=![]()
查看答案和解析>>
科目: 来源: 题型:
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。

(1)反应开始时反应速率加快的原因是_______________________________________。
(2)反应后期反应速率下降的原因是_________________________________________。
(3)若纵坐标表示的某一反应物的单位时间内的浓度变化,图中阴影部分的“面积”表示_________________________ _______________。
查看答案和解析>>
科目: 来源: 题型:
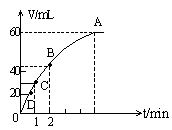
加入0.1molMnO2粉末于50mL的H2O2中(密度![]() )在标准状况下放出的气体体积与时间的关系如图所示:
)在标准状况下放出的气体体积与时间的关系如图所示:
(1)实验时放出的气体总体积是 。
(2)反应放出―半气体所需时间是 。
(3)反应放出![]() 气体所需的时间约为 。
气体所需的时间约为 。
(4)A、B、C、D各点批反应速率快慢的顺序是 。
(5)解释上述A、B、C、D快慢的原因是 。
查看答案和解析>>
科目: 来源: 题型:
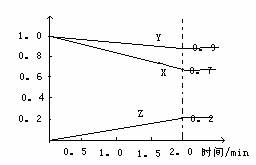
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化,曲线如右图所示,由图中数据分析,该可逆反应的化学方程式为 ;
该反应开始至2min,Z的平均反应速率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com