
科目: 来源: 题型:
下列各组物质的溶液相互反应,无论前者逐滴滴入后者,还是后者逐滴滴人前者,反应现象均相同的是
①HCl和Na[Al(OH)4] ②Ca(HCO3)2和Ca(OH)2
③稀H2SO4和Fe(OH)3胶体 ④NaHCO3和HCl
A.①② B.②③ C.①④ D.②④
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起同样的保护作用
B.电解精炼铜时,相同时间内阴极析出铜的质量比阳极溶解铜的质量大
C.稀硝酸、浓硫酸均能将木炭氧化成二氧化碳
D.工业上,半导体材料硅的应用非常广泛,其制备过程不涉及氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A.金属钠投入CuS04溶液中:2Na+Cu2+=2Na++Cu
B.硫酸铝溶液中加入足量氨水:Al3++40H一=[Al(OH)4]一
C.FeSO4溶液与稀硝酸反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
D.硫酸溶液中滴加足量氢氧化钡溶液:H++SO42-+Ba2++OH一=H2O+BaSO4
查看答案和解析>>
科目: 来源: 题型:
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内是离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2 MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当O.1molZn完全溶解时,流经电解液的电子个数为1.204×1023
D.电池正极反应式为:2MnO2+2e-+2H2O――2MnO(OH)+20H-
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
 A.2008年诺贝尔化学奖授予在绿色荧光蛋白质的发现和研究方面做出贡献的科学家。绿色荧光蛋白质不能发生水解
A.2008年诺贝尔化学奖授予在绿色荧光蛋白质的发现和研究方面做出贡献的科学家。绿色荧光蛋白质不能发生水解
B.三聚氰胺俗称“蛋白精”,分子结构见右图,它是一种新的蛋白质
C.乙酸与乙醇在一定条件下发生酯化反应,加入浓H2SO4有利于酯 化反应的进行
D.工业上,石油分馏可以得到乙烯,因此,世界上已将乙烯的产量作为衡量一个国家石油化工发展水平的标志
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是
A. Na2O2、HClO、SO2等物质都具有漂泊作用
B.液氨、液氯、液态氯化氢都是电解质
C.所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化反应
D.非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应
查看答案和解析>>
科目: 来源: 题型:
不同元素的原子在分子内吸引电子的能力大小可用x 表示,x越大、其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短周期元素的 x 值。
| 元素 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.25 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
⑴通过分析 x 值的变化规律,确定 Mg、N 的 x 值范围:
x ( Mg ): , x ( N ): 。
⑵x 值与原子半径的大小有什么关系? , 短周期元素 x 值的变化特点体现了元素性质的 变化规律。
⑶某有机物的结构简式为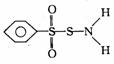 其中S―N键中你认为电子对偏向 。
其中S―N键中你认为电子对偏向 。
⑷经验规律告诉我们,当成健的两原子相应元素的 x 差值(△x)大于1.7时一般形成离子键,。△x<1.7时一般形成共价键,试判断:AlBr3中化学键的类型是 。
⑸预测元素周期表中, x 值最小的元素位置: (放射性元素除外)。
查看答案和解析>>
科目: 来源: 题型:
如右图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6mol?L―1的硫酸。其他试剂任选。填写下列空白:
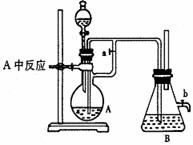
(1)B中盛有一定的NaOH,A中应预先加入的是 。A中反应的离子方程式是 。
(2)实验开始时应先将活塞a (填“打开”或“关闭”)
(3)简述生成Fe(OH)2的操作过程: 。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中观察到的现象为 。
查看答案和解析>>
科目: 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
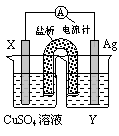
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为______________________________;
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
查看答案和解析>>
科目: 来源: 题型:
氮化钠(Na3N是科学家制备的一种重要的化合物,它与水作用产生NH3,试回答:
⑴Na3N与水反应的方程式是: ,
该化合物是由 键形成。
⑵Na3N与盐酸反应生成 种盐,其化学式是 。
⑶比较Na3N中两种微粒的半径火小: r ( Na + ) r ( N3-)。(填“>”“=”、“< ”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com