
科目: 来源: 题型:
某工厂以精辉铜矿(主要成份为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):
![]() 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2 2 Cu2O + Cu2S → 6 Cu + SO2
2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2 2 Cu2O + Cu2S → 6 Cu + SO2
![]() (1)若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
(1)若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
![]()
![]()
![]()
![]() (2)若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
(2)若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
![]()
![]()
![]()
![]()
![]()
![]()
![]() (3)今将a mol Cu2S 与b mol 空气(氧气约占空气体积的20%)在密闭容器中高温下发生反应,请完成下列表格:
(3)今将a mol Cu2S 与b mol 空气(氧气约占空气体积的20%)在密闭容器中高温下发生反应,请完成下列表格:
反应后固体
| Cu | Cu2S 、Cu | Cu2O、 Cu |
b的取值范围 |
|
|
|
查看答案和解析>>
科目: 来源: 题型:
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:![]()
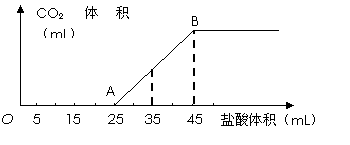 |
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)写出OA段所发生反应的离子方程式_______________________________、 ______________。
![]() (2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
![]() (3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
查看答案和解析>>
科目: 来源: 题型:
一种用于治疗高血脂的新药――灭脂灵可按如下路线合成:
已知① 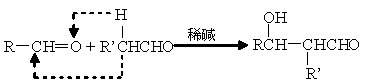
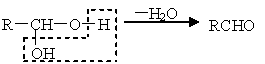
②
又知G的分子式为C10H22O3,试回答:
![]() ⑴写出B、E的结构简式:B__________________,E________________。
⑴写出B、E的结构简式:B__________________,E________________。
⑵反应①~⑤中属于取代反应的有_____________。
⑶反应②的化学方程式为______________________________________________。
⑷反应⑤的化学方程式为______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解是指在催化条件下实现C=C双键断裂两边基团换位的反应。
![]() 如图表示两个丙烯分子进行烯烃复分解,生成两个新的烯烃分子:2―丁烯和乙烯。
如图表示两个丙烯分子进行烯烃复分解,生成两个新的烯烃分子:2―丁烯和乙烯。
![]()

![]() 现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;
现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;
![]()
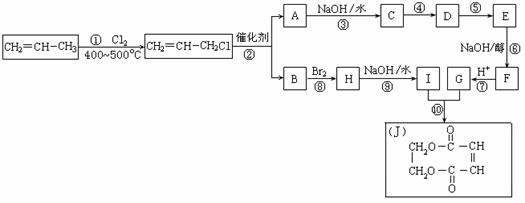
![]()
![]() (1)反应①的类型:____________反应 ; G的结构简式:______________ ;
(1)反应①的类型:____________反应 ; G的结构简式:______________ ;![]()
![]() (2)反应②的化学方程式是___________________________________________ ;
(2)反应②的化学方程式是___________________________________________ ;
![]() (3)反应④中C与HCl气体在一定条件只发生加成反应,反应④和⑤不能调换的原因是
(3)反应④中C与HCl气体在一定条件只发生加成反应,反应④和⑤不能调换的原因是![]() ______________________,E的结构简式:_____________ ;
______________________,E的结构简式:_____________ ;![]()
![]() (4)反应⑨的化学方程式:___________________________________________ 。
(4)反应⑨的化学方程式:___________________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
![]()
 |
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1) ![]() 溴在元素周期表中位于_________周期,_________族。
溴在元素周期表中位于_________周期,_________族。
(2) ![]() 步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。
步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。
(3) ![]() 步骤④的离子方程式:________________________________________ 。
步骤④的离子方程式:________________________________________ 。
(4) ![]() 步骤⑥的蒸馏过程中,溴出口温度要控制在80―900C。温度过高或过低都不利于生产 ,请解释原因:__________________________________________ 。
步骤⑥的蒸馏过程中,溴出口温度要控制在80―900C。温度过高或过低都不利于生产 ,请解释原因:__________________________________________ 。
(5) ![]() 步骤⑧中溴气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_____________,分离时液溴从分离器的_____(填“上口”或“下口”)排出。
步骤⑧中溴气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_____________,分离时液溴从分离器的_____(填“上口”或“下口”)排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氧化”的原因是 。
查看答案和解析>>
科目: 来源: 题型:
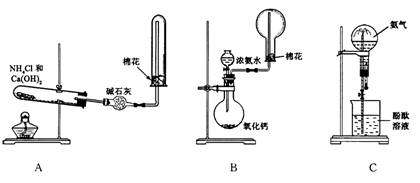
下图中A、B、C分别是某课外活动小组设计的制取氨气并进行喷泉实验的三组装置示意图,制取NH3选用试剂如图所示,回答下列问题:
 |
![]()
![]()
![]()
![]()
![]()
(1)用A图所示的装置可制备干燥的NH3
![]() ①反应的化学方程式为:________________________________________。装置中收集NH3的试管口放置棉花团的作用是_________________________________________。
①反应的化学方程式为:________________________________________。装置中收集NH3的试管口放置棉花团的作用是_________________________________________。
![]() ②干燥管中干燥剂能否改用无水CaCl2___________,理由是_________________________。
②干燥管中干燥剂能否改用无水CaCl2___________,理由是_________________________。
![]() (2)用B图所示的装置可快速制取较大量NH3拟作喷泉实验。
(2)用B图所示的装置可快速制取较大量NH3拟作喷泉实验。
![]() 根据B图所示的装置及试剂回答下列问题:
根据B图所示的装置及试剂回答下列问题:
![]() ①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:__________________________________
①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:__________________________________
![]() ②检验NH3是否收集满的实验方法是:_________________________________________
②检验NH3是否收集满的实验方法是:_________________________________________
![]() (3)用C图所示的装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是___________________________,该实验的原理是:_______________________________。
(3)用C图所示的装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是___________________________,该实验的原理是:_______________________________。
![]() 若测得C装置烧瓶中NH3的质量是相同状况下相同体积H2质量的10倍,则喷泉实验完毕后,烧瓶中水可上升至烧瓶容积的___________(填“几分之几”)。
若测得C装置烧瓶中NH3的质量是相同状况下相同体积H2质量的10倍,则喷泉实验完毕后,烧瓶中水可上升至烧瓶容积的___________(填“几分之几”)。
查看答案和解析>>
科目: 来源: 题型:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: ![]()
![]()
![]() (1)该反应的平衡常数表达式为K=________________;
(1)该反应的平衡常数表达式为K=________________;
![]() (2)若知上述反应为放热反应,则升高温度,其平衡常数值 (选填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol?L-1?min-1,则N2消耗速率为v(N2)= 。
(2)若知上述反应为放热反应,则升高温度,其平衡常数值 (选填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol?L-1?min-1,则N2消耗速率为v(N2)= 。
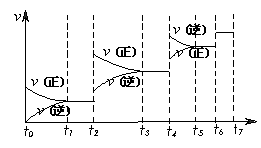
(3)达到平衡后,改变某一外界条件,反应速率![]() 与时间t的关系如图:
与时间t的关系如图:
 |
![]()
![]()
![]()
![]()
![]()
t
![]()
若不改变N2、CO的量,则图中t4时引起平衡移动的条件可能是 ____________;图中t6时引起变化的条件是 _______________________________;图中表示平衡混合物中CO的含量最高的一段时间是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com