
科目: 来源: 题型:
常温下amolFe恰好完全溶解在含bmolHNO3的某浓度硝酸溶液中,生成cmol的气体。若已知Fe可溶于含Fe3+的溶液中:Fe+2Fe3+=3Fe2+,则下列情况不可能的是 ( )
A.产生红棕色气体,后产生无色气体,有cmolHNO3被还原
B.a与c的比值在下列值之间:1∶3~3∶2
C.当b=2a+c时,b=4c;当b=3a+c时,b=4c
D.当2a+c<b<3a+c时,b=4c
查看答案和解析>>
科目: 来源: 题型:
已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
![]()
![]()
![]() CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1
![]()
![]()
![]() 现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是
![]()
![]()
![]() A.1∶1 B.1∶3
A.1∶1 B.1∶3
![]()
![]()
![]() C.1∶4 D.2∶3
C.1∶4 D.2∶3
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g) 2CO2(g); △H=-566kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(1); △H=-890kJ·mol-1
又知由H2与O2反应生成液态H2O 比生成气态H2O 多放出44kJ/mol的热量。则CH4 气体在空气中不完全燃烧热化学方程式正确的是
A.2CH4(g)+O2(g) CO2(g)+CO(g)+4H2O(1) △H=-1214kJ·mol-1
B.2CH4(g)+O2(g) CO2(g)+CO(g)+4H2O(g) △H=-1038kJ·mol-1
C.3CH4(g)+5O2(g) CO2(g)+2CO(g)+6H2O(1) △H=-1538kJ·mol-1
D.3CH4(g)+5O2(g) CO2(g)+2CO(g)+6H2O(g) △H=-1840kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z三者均为短周期元素,已知X元素有一种同位素不含中子,Y元素原子的最外层电子数是次外层电子数的2倍,Z元素原子的最外层电子数是次外层电子数的3倍。下列化学式①XYZ3、②X2YZ2、③X2YZ3、④X2Y2Z2、⑤X2Y2Z4、⑥X4Y2Z2中,并非都存在的一组分子是
A.①② B.④⑥ C.③⑤ D.②④
查看答案和解析>>
科目: 来源: 题型:阅读理解
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有: 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O![]() C6H12O6 b.CO2 + 3H2
C6H12O6 b.CO2 + 3H2![]() CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4![]() CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2![]() CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
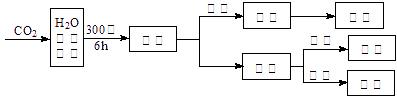
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。
CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:
HCOOH是CO2转化为CH4的中间体, 即:CO2![]() HCOOH
HCOOH![]() CH4
CH4
①写出产生H2的反应方程式 。
②由图可知,镍粉是 。(填字母)
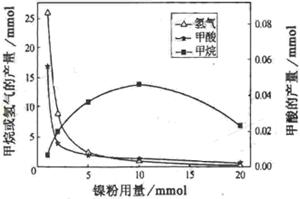
a.反应的催化剂
b.反应的催化剂
c.反应的催化剂
d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应ⅠⅡ的速率均不变
d.反应ⅠⅡ的速率均增加,且反应Ⅰ的速率增加得快
e.反应ⅠⅡ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
查看答案和解析>>
科目: 来源: 题型:
某气态烃0.5 mol能与1 mol HCl完全加成,加成后的产物可被3 mol Cl2取代,则此烃可能是( )
A.H≡C B.CH2==CH2
C.CH≡C—CH3 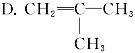
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com