
科目: 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2升的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数为4NA
C.标准状况下,11.2升二氯甲烷所含分子数为0.5NA
D.现有C2H4、C3H6、C4H8的混合气体共14g,其原子数为3NA
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A.Fe3O4溶于稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.铝片溶于NaOH溶液:Al+2OH-=AlO2-+H2↑
C.向苯酚钠溶液中通入少量CO2;C6H5O-+CO2+H2O→C6H5OH+HCO3-
D.向含1mol碘化亚铁的溶液中通入标准状况下22.4L氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目: 来源: 题型:
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
查看答案和解析>>
科目: 来源: 题型:
21A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
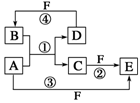
(1) 若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则A元素在周期表中的位置 ,D的原子结构示意图为 ,
反应①的化学方程式为_____________________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。
反应②也在水溶液中进行,其离子方程式是________________________,
已知光照条件下D与F反应生成B,写出该反应的化学方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
元素性质呈现周期性变化的根本原因是
A.元素的相对原子质量递增,量变引起质变
B.元素原子的核外电子排布呈周期性变化
C.元素的原子半径呈周期性变化
D.元素的化合价呈周期性变化
查看答案和解析>>
科目: 来源: 题型:
下列关于Li、Na、K、Rb、Cs结构与性质的比较中,不正确的是
A.它们的原子核外电子层数随核电荷数的增加而增多
B.它们的最高价氧化物对应水化物的碱性随核电荷数的增加而增强
C.它们的单质的熔沸点随核电荷数的增加而逐渐升高
D.它们的单质与氧气或水反应的剧烈程度随核电荷数的增加而越来越剧烈
查看答案和解析>>
科目: 来源: 题型:
在超高压下,科学家用激光器将CO2加热到1800K,成功制得了类似石英的CO2原子晶体。下列关于CO2原子晶体的叙述中不正确的是
A.晶体中C、O原子个数比为1∶2 B.该晶体的熔沸点、硬度都高于石英
C.晶体中含有“CO4”的结构单元 D.晶体中最小的原子环为六元环
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com