
科目: 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:选择题
下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+
查看答案和解析>>
科目: 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:选择题
某温度、压强下,将一定量反应物通入密闭容器进行反应
SiCl4(g)+2H2(g)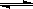 Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.若单位时间内生成x molHCl的同时,生成x molH2,则反应达到平衡状态
D.使用过量的H2或升高温度都可以提高SiCl4的转化率
查看答案和解析>>
科目: 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:选择题
下列事实可以用勒夏特列原理解释的是( )
A.新制的氯水在光照条件下颜色变浅
B.使用催化剂,提高合成氨的产量
C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
D.H2、I2、HI平衡混合气体加压后颜色变深
查看答案和解析>>
科目: 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:选择题
下列关于右图装置的说法正确的是( )
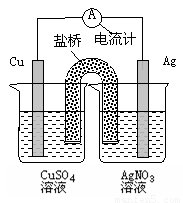
A.银电极是负极
B.铜电极上发生的反应为Cu-2e-=Cu2+
C.外电路中的电子是从银电极流向铜电极。
D.该装置能将电能转化为化学能
查看答案和解析>>
科目: 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:选择题
某温度下,反应2CH3OH(g)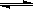 CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
下列说法正确的是 ( )
A.CH3OH的起始浓度为1.04 mol/L B. 平衡时CH3OH的浓度为0.04 mol/L
C.此时逆反应速率大于正反应速率 D.平衡时CH3OH的转化率小于80%
查看答案和解析>>
科目: 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:选择题
在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
A. 平衡向逆反应方向移动 B. a + b < c + d
C. Z的体积分数增大 D. X的转化率下降
查看答案和解析>>
科目: 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:选择题
投入一定量的物质A和B发生可逆反应:2A(g)+nB(g)  mC(g) ,在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的物质的量与时间的关系如右图所示, 有关该反应的说法正确的是( )
mC(g) ,在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的物质的量与时间的关系如右图所示, 有关该反应的说法正确的是( )

A. n+2<m 该反应正反应为放热反应
B. n+2<m 该反应正反应为吸热反应
C. n+2>m 该反应正反应为放热反应
D. n+2>m 该反应正反应为吸热反应
查看答案和解析>>
科目: 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:选择题
1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )
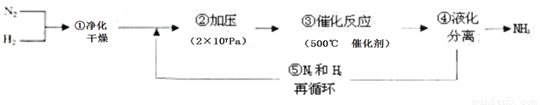
A.①②③ B.②④⑤ C.①③⑤ D.②③④
查看答案和解析>>
科目: 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:选择题
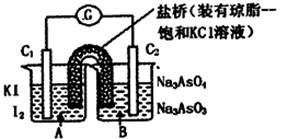
已知反应AsO43-+2I-+2H+ 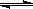 AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转.据此,下列判断正确的是( )
A.操作Ⅰ过程中,C1为正极
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e-=AsO33-+H2O
D.Ⅱ操作过程中,C1棒上发生的反应为:2I――2e-=I2
查看答案和解析>>
科目: 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:填空题
(7分)把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) === CO2(g)
途径II:先制水煤气: C(s) + H2O(g) === CO(g) + H2(g)
燃烧水煤气:2 CO(g) + O2(g) === 2CO2(g); 2H2(g)+O2(g) ===2H2O(g)
已知:①C(s)+O2(g)===CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+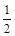 O2(g)=H2O(g);△H2=-241.8kJ·mol-1
O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+ 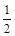 O2
(g) =CO2(g);△H3=-283.0kJ·mol-1
O2
(g) =CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C(煤)的标准燃烧热是
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量
(4)根据两种途径,下列说法错误的是 (单选)
A.途径II制水煤气时增加能耗,故途径II的做法不可取
B.与途径I相比,途径II可以减少对环境的污染
C.与途径I相比,途径II可以提高煤的燃烧效率
D.将煤转化为水煤气后,便于通过管道进行运输
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com