
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
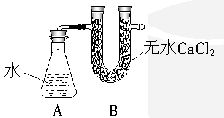
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
配制一定体积的溶液,要用到一种特殊的仪器:容量瓶。
(1)使用容量瓶时应遵循以下原则:首先,选择___________的容量瓶;其次,尽可能将________转移到容量瓶中;第三,确保向容量瓶中加水时不超过___________________。
(2)某同学A想从试剂瓶内取出95mL的NaOH溶液,A能否用规格为100mL的容量瓶来取?为什么?
(3)某同学B在配制一定浓度的NaCl溶液时,当B将烧杯里的溶液注入容量瓶中时,发现瓶内液体的液面恰好达到容量瓶的刻度线,这个巧合令B非常高兴。请你分析B所配制的溶液浓度是否准确?为什么?
(4)某同学C在配制一定浓度的NaCl溶液时,在最后加水时,发现液面略微超出刻度线,C用滴管将上面的液体吸取出来。你认为这个做法可取吗?为什么?
(5)某同学D在配制一定浓度的NaOH溶液时,当D将称量好的NaOH固体溶解在水中后,迅速、完全地将溶液转移到容量瓶中,然后加水至刻度线。你认为D的做法有无错误?为什么?
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 2AlN+3CO。由于反应不完全,氮化铝产品中往往含有碳和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
2AlN+3CO。由于反应不完全,氮化铝产品中往往含有碳和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:查看答案和解析>>
科目: 来源: 题型:
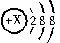
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com