
科目: 来源: 题型:
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A.一个D2O分子所含2的中子数为8 B.NH3的结构式为![]()
C.HCl的电子式为![]() D.热稳定性:H2S>HF
D.热稳定性:H2S>HF
查看答案和解析>>
科目: 来源: 题型:
空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是( )
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
查看答案和解析>>
科目: 来源: 题型:
已知: 4NH3十5O2 → 4NO+6H2O 4NO十3O2十2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算
(1)amolNO完全转化为HNO3需要氧气_______ mol
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为______(保留2位小数)。
(3)20.0moL的NH3用空气氧化,产生混合物的组成为:NO18.0mol、O212.0 mol、N2150.0 mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率。
(4) 20.0moL 的NH3和一定量空气充分反应后,再转化为HNO3
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
②写出当125≤n(B) ≤ 200时,n(A)和n(B)的关系式_________________________________。

查看答案和解析>>
科目: 来源: 题型:
合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为___________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为_____________(用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2 Fe2O3十C → 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_________g。
查看答案和解析>>
科目: 来源: 题型:
已知![]() (注:R,R’为烃基)
(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
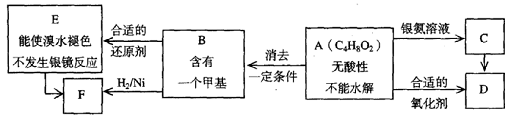
试回答
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________b.能发生水解反应______________________
(2)A分子中的官能团是_____________,D的结构简式是_____________。
(3)C→D的反应类型是___________,E→F的反应类型是___________
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(4)写出化学方程式:A→B____________________________________________。
(5)写出E生成高聚物的化学方程式:____________________________________________。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:______________________________
查看答案和解析>>
科目: 来源: 题型:
已知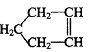 可简写为
可简写为
降冰片烯的分子结构可表示为: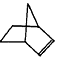
(1)降冰片烯属于__________。
a.环烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为__________。
(4)降冰片烯不具有的性质__________。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
查看答案和解析>>
科目: 来源: 题型:
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
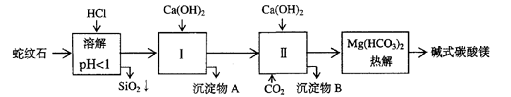
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见右表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是__________________
(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解
③____________________________________
④____________________________________
⑤MgO称量
(6)18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________ b =_________ C =_________
查看答案和解析>>
科目: 来源: 题型:阅读理解
(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)

由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式) 理由是_______________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是_________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫 b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体 d.气体进入D装置前未用浓硫酸干燥
(B)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯


(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是________________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目: 来源: 题型:
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________________,
K值大小与温度的关系是:温度升高,K值______________
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) ![]() CO2(g)十H2 (g)十Q(Q>0)
CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)=______ mol/(L?min)

(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于_________状态;
C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min问,平衡向逆方向移动,可能的原因是________(单选),
表中5min-6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目: 来源: 题型:
(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________→__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
____________+ __________→
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com